文章來源:小藥說藥
-01-
引言:從“無人問津”到“政策破冰”
-02-
一、政策支持:從頂層設(shè)計到審評加速
中國罕見病藥物研發(fā)的崛起,離不開國家層面的政策傾斜:??
法規(guī)體系完善:2019年《藥品管理法》與2020年《藥品注冊條例》明確罕見病藥物優(yōu)先審評審批機(jī)制,2022年《罕見病藥物臨床研究與開發(fā)指南》進(jìn)一步細(xì)化試驗設(shè)計規(guī)范,為研發(fā)提供制度保障。??
目錄擴(kuò)容與醫(yī)保覆蓋:兩批罕見病目錄的發(fā)布,以及部分藥物納入國家醫(yī)保,顯著提升藥物可及性。2023年,藥監(jiān)局將罕見病用藥列為重點領(lǐng)域,加速審批流程,全年近40種罕見病藥物獲批上市。??
資金與激勵措施:政府資金占研發(fā)投入的46.7%,稅收減免、研發(fā)補貼等政策吸引企業(yè)布局。例如,2023年上市申請階段藥物達(dá)27款,涉及22種罕見病。??
-03-
二、研發(fā)格局:治療領(lǐng)域與藥物類型的差異化突破
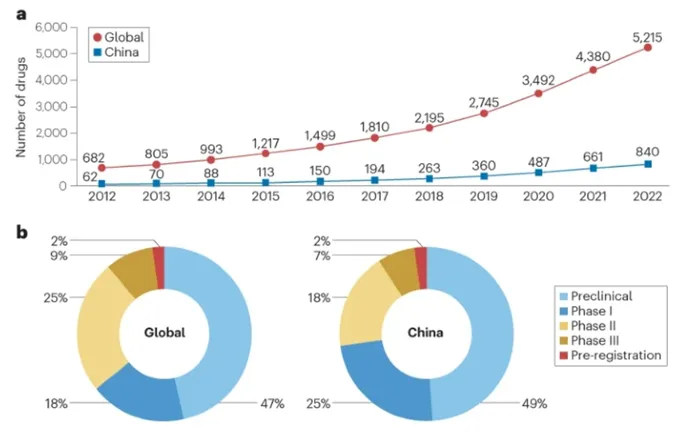
在過去十年中,中國在罕見病藥物研發(fā)方面發(fā)生了巨大的變化。從2012年到2022年,全球和中國臨床前和臨床開發(fā)中的罕見病藥物數(shù)量有所增加。在過去五年中,中國正在研制的罕見病藥物數(shù)量大幅增加,年均增長率為34%,而全球在研藥物的增長率為24%。截至2022年底,中國共有840種罕見病藥物正在研發(fā)中,其中412種(49%)處于臨床前階段。對于所有已批準(zhǔn)試驗新藥(IND)申請的藥物,206種(25%)藥物已處于I期,152種(18%)藥物已進(jìn)入II期,56種(7%)藥物已進(jìn)入III期,14種(2%)藥物處于預(yù)注冊階段。相比之下,截至2022年底,全球有5215種罕見病藥物正在開發(fā)中,每個開發(fā)階段的分布相似。
對所有罕見病藥物的分析顯示,腫瘤學(xué)是全球和中國最活躍的治療領(lǐng)域,占全球的43%,占中國的71%。深入研究腫瘤學(xué)領(lǐng)域的個別適應(yīng)癥,中國前六大適應(yīng)癥與全球適應(yīng)癥相似但不完全相同。非霍奇金淋巴瘤、胰腺癌、骨髓瘤、急性髓細(xì)胞性白血病和卵巢癌出現(xiàn)在前六位,而全球前六位中的胃癌在中國不被視為罕見腫瘤,這與這些疾病發(fā)病率的差異一致。
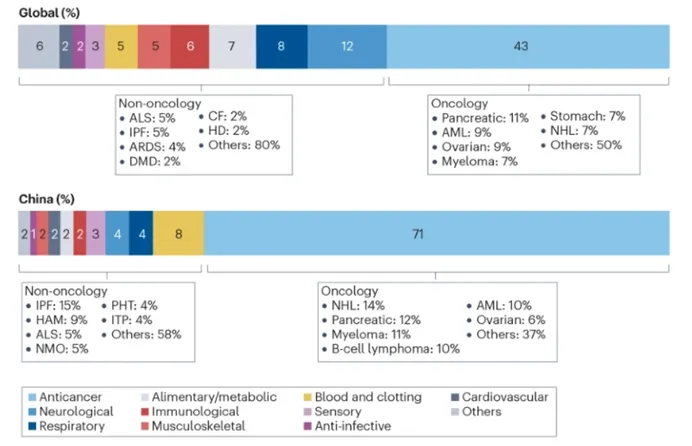
除腫瘤學(xué)外,全球第二大治療領(lǐng)域是神經(jīng)系統(tǒng)疾病(12%)、呼吸系統(tǒng)疾病(8%)、消化系統(tǒng)/代謝系統(tǒng)疾病(7%)和免疫系統(tǒng)疾病(6%)。值得注意的是,中國的關(guān)注點不同,在中國開發(fā)的所有藥物中,只有4%用于神經(jīng)疾病,2%用于消化道/代謝性疾病,這些領(lǐng)域可能存在大量未滿足的醫(yī)療需求。近年來,在中國國家罕見病登記系統(tǒng)的支持下,神經(jīng)和代謝性罕見病臨床隊列的建立一直在收集更多信息,以促進(jìn)這些領(lǐng)域的藥物開發(fā)。
-04-
三、臨床轉(zhuǎn)化與可及性:進(jìn)步與挑戰(zhàn)并存
診療能力提升:罕見病協(xié)作網(wǎng)覆蓋324家醫(yī)院,69.2%的醫(yī)生知曉首批目錄,50%有診療經(jīng)驗。多學(xué)科會診(MDT)參與率達(dá)35.4%,但基層醫(yī)院能力仍待加強。??
藥物可及性改善:60%的醫(yī)生可通過醫(yī)院藥房開藥,近半數(shù)患者依賴院外藥房。然而,23.5%的患者需參與臨床試驗,10.3%依賴慈善項目,部分高價藥(如年費超百萬元的特效藥)仍未納入醫(yī)保。??
患者參與研發(fā)機(jī)制:患者組織正從“被動接受者”轉(zhuǎn)向研發(fā)推動者。例如,蔻德罕見病中心等機(jī)構(gòu)通過社群力量加速藥物研發(fā),2023年《患者參與藥物研發(fā)指引》的發(fā)布進(jìn)一步規(guī)范了這一模式。??
-05-
結(jié)語:讓“罕見”被看見,讓希望可觸及
中國罕見病藥物研發(fā)的快速發(fā)展,是政策、科技與社會合力的結(jié)果。從“無藥可用”到“源頭創(chuàng)新”,中國罕見病藥物研發(fā)的蛻變,映照著一個國家對生命的敬畏。若能用好政策紅利、突破技術(shù)瓶頸、構(gòu)建可持續(xù)生態(tài),我們終將在這條“少有人走的路”上,走出中國特色的創(chuàng)新模式——這不僅是科學(xué)問題,更是一場關(guān)于社會公平與文明高度的考驗。每一次技術(shù)進(jìn)步,都是對罕見病患者生存權(quán)利的重新定義。
參考資料:
1.Trends in rare disease drug development. Nat Rev Drug Discov.2023 Nov 6.
