文章來源:米內網
編輯說:2025年2月,3個1類新藥首次申請上市;改良型新藥方面,9個品種有新適應癥申報上市,其中3個品種合并新劑型和新適應癥;224個品種按新分類仿制申報一致性評價,其中47個品種暫無國內仿制獲批,富馬酸伏諾拉生片的申報企業最多,石家莊四藥申報品種數最多;27個存量品種有企業申報一致性評價,其中2個品種為首次申報。
摘要
abstract2025年2月,3個1類新藥首次申請上市;改良型新藥方面,9個品種有新適應癥申報上市,其中3個品種合并新劑型和新適應癥;224個品種按新分類仿制申報一致性評價,其中47個品種暫無國內仿制獲批,富馬酸伏諾拉生片的申報企業最多,石家莊四藥申報品種數最多;27個存量品種有企業申報一致性評價,其中2個品種為首次申報。
創新藥品種上市申請情況
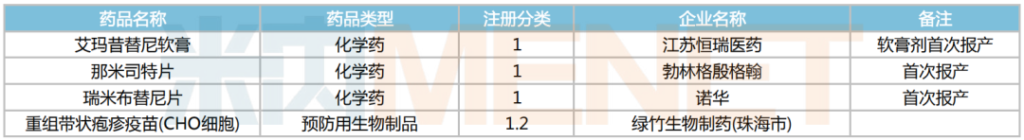
2025年2月,4個1類新藥申請上市,其中3個品種為首次申報上市。江蘇恒瑞醫藥的艾瑪昔替尼是一款JAK1抑制劑,在2023年恒瑞已提交過該藥的片劑上市申請,本次軟膏劑報產擬用于成人輕度至中度特應性皮炎的局部外用治療。勃林格殷格翰的那米司特是一款PDE4B抑制劑,本次報產擬用于治療成人特發性肺纖維化。而諾華的瑞米布替尼為一款BTK抑制劑,本次報產擬用于治療慢性自發性蕁麻疹。
2025年2月創新藥上市申請承辦情況
改良型新藥品種上市申請情況
2025年2月,9個改良型新藥品種的上市申請獲CDE承辦。HR19034滴眼液(成都盛迪醫藥)、枸地氯雷他定口服溶液(合肥恩瑞特藥業)、洛索洛芬鈉滴眼液(潤爾眼科藥物)等3個品種為新劑型+適應癥報產,其他品種均為新適應癥報產。
2025年2月改良型新藥上市申請承辦情況

一致性評價申請情況
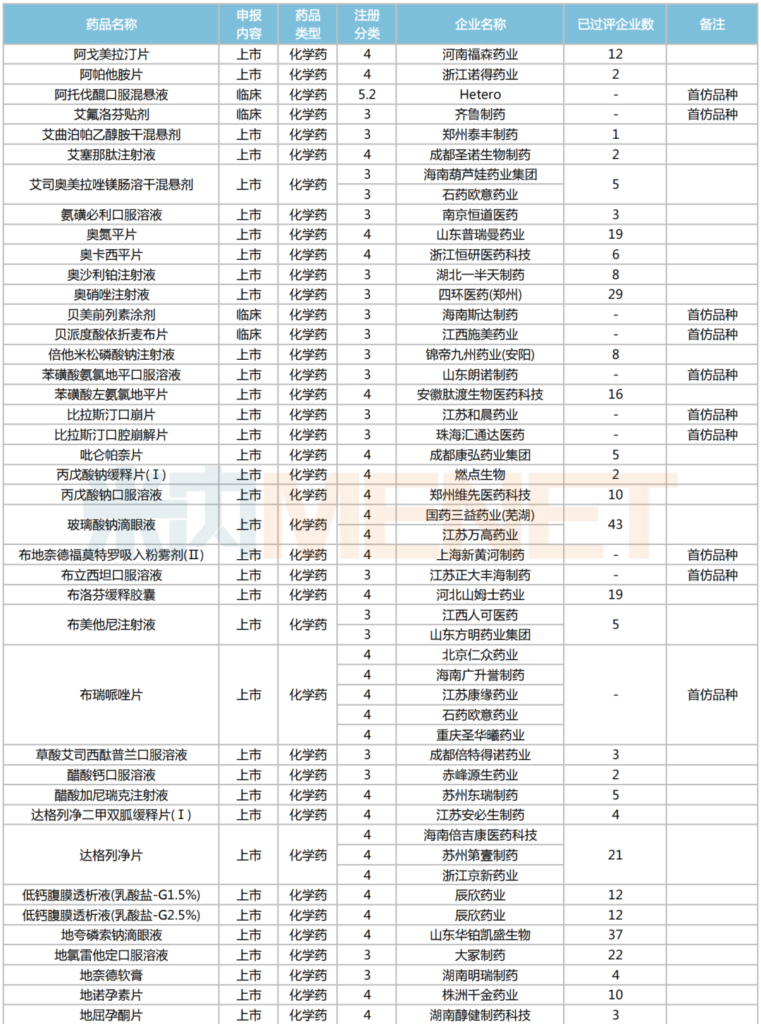
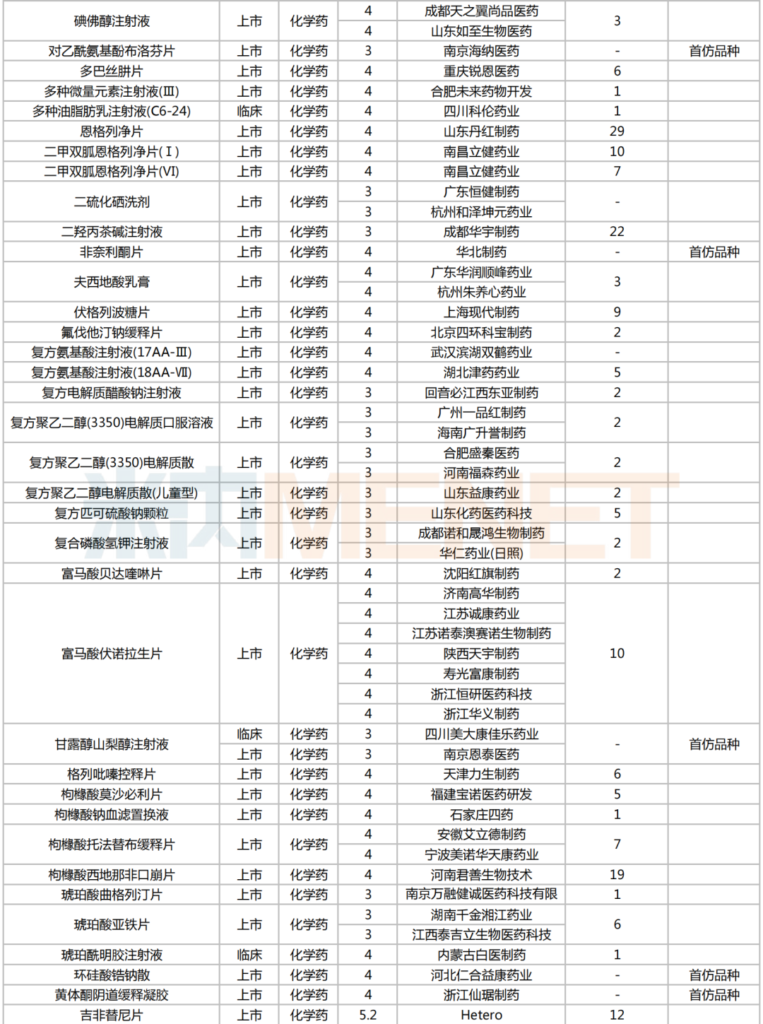
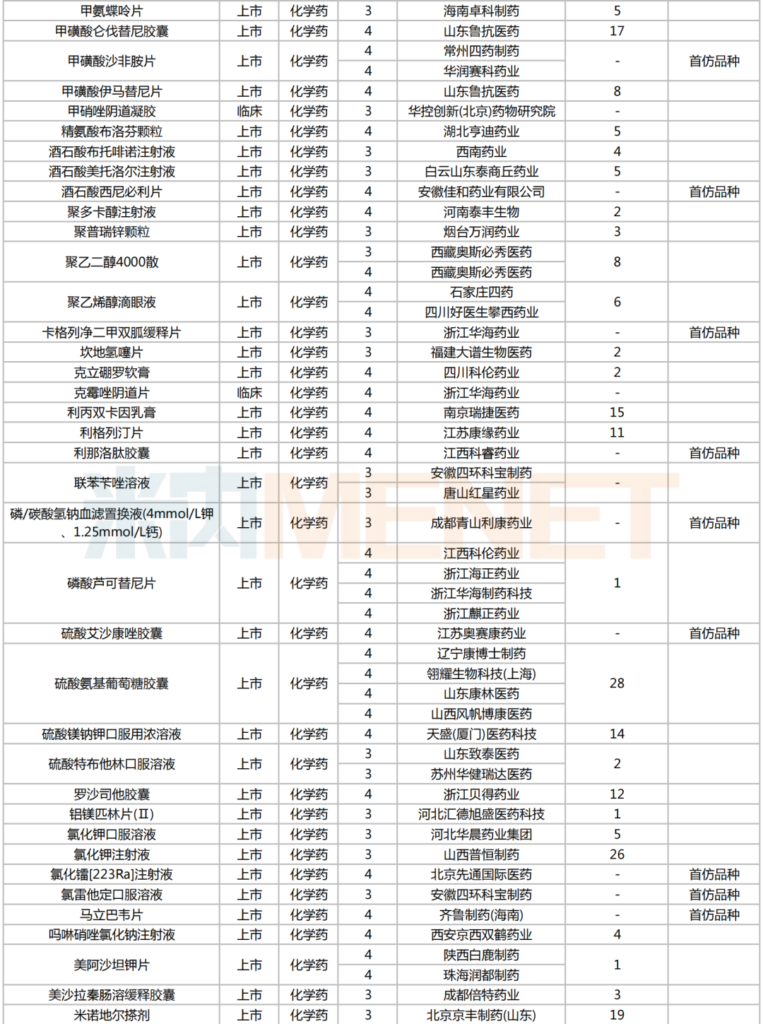
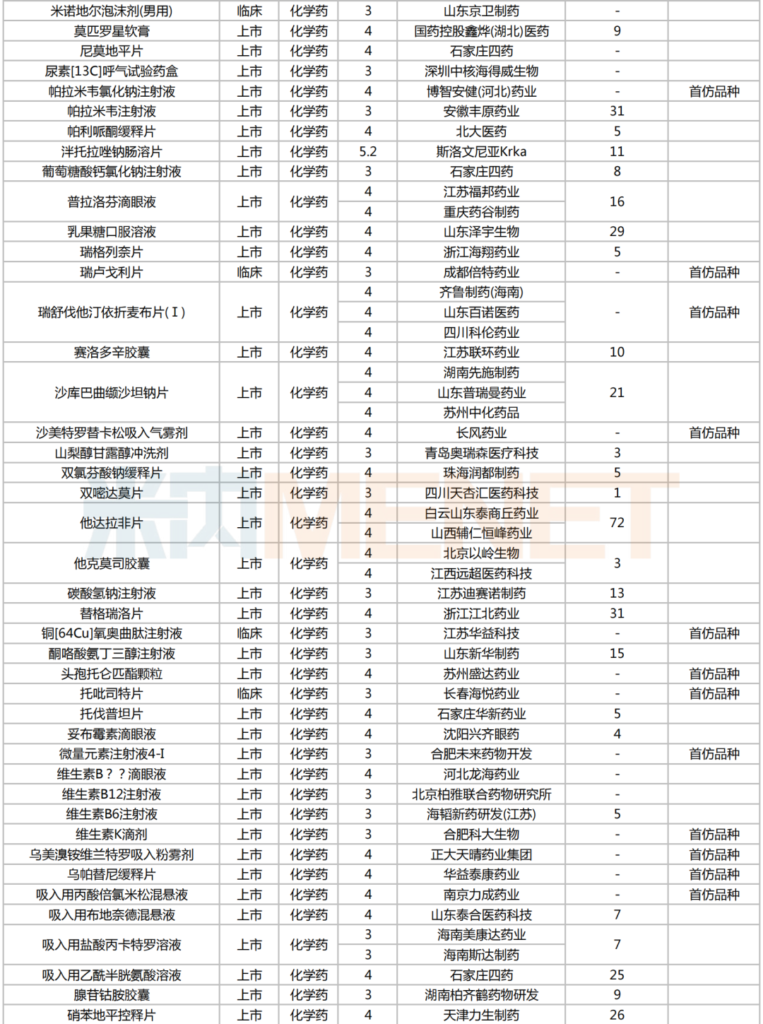
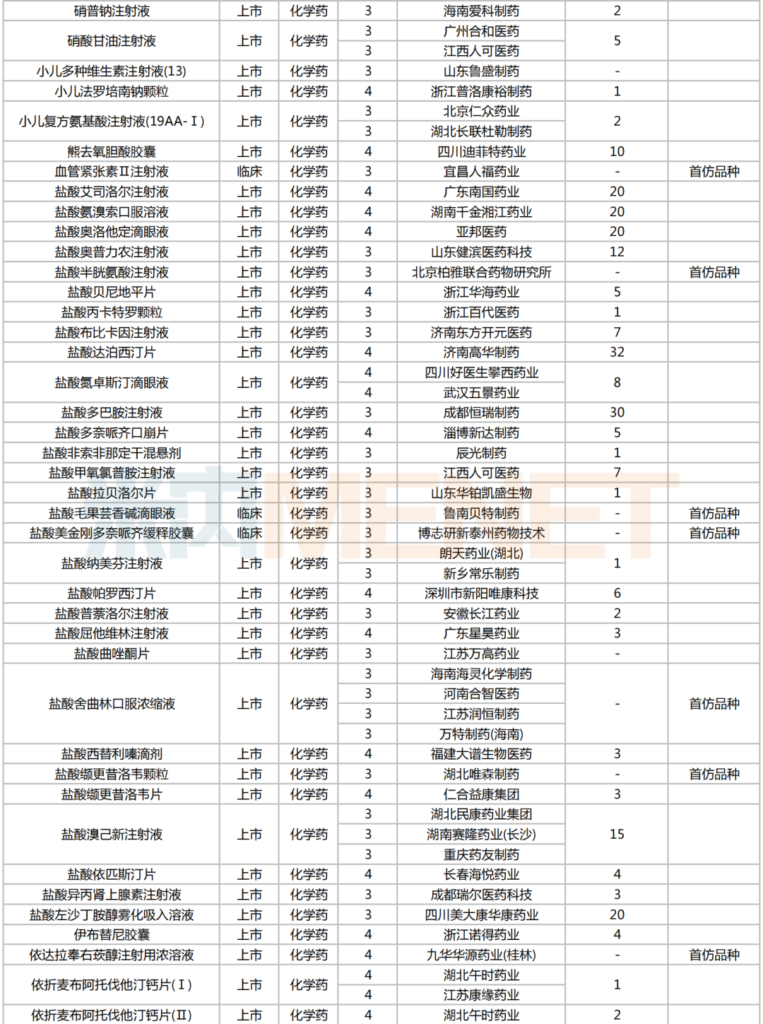
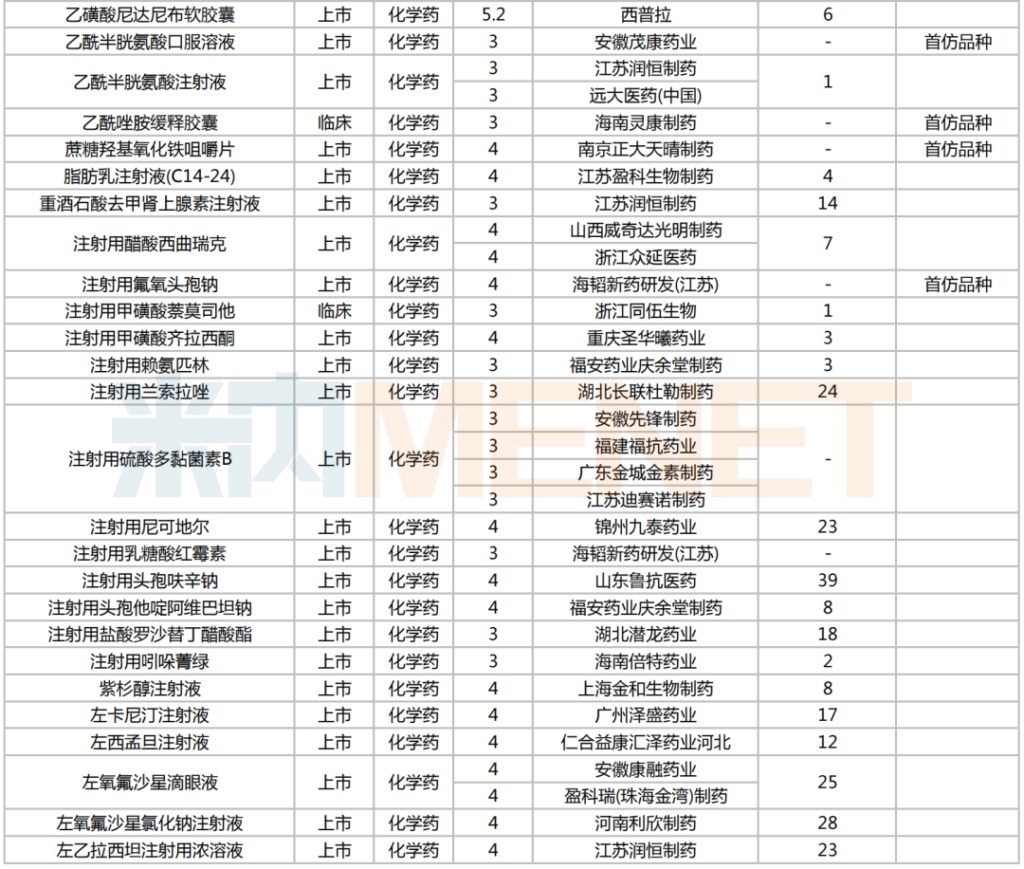
2025年2月,224個品種按新分類仿制申請獲CDE承辦,其中47個品種在中國境內暫無仿制藥獲批。有6個品種申報企業數在4家及以上:富馬酸伏諾拉生片(7家),布瑞哌唑片(5家),注射用硫酸多黏菌素B、鹽酸舍曲林口服濃縮液、硫酸氨基葡萄糖膠囊、磷酸蘆可替尼片(均為4家)。有2家企業申報品種數較多:石家莊四藥(5個)、江蘇潤恒制藥(4個)。
2025年2月一致性評價申請情況(新分類仿制申請)
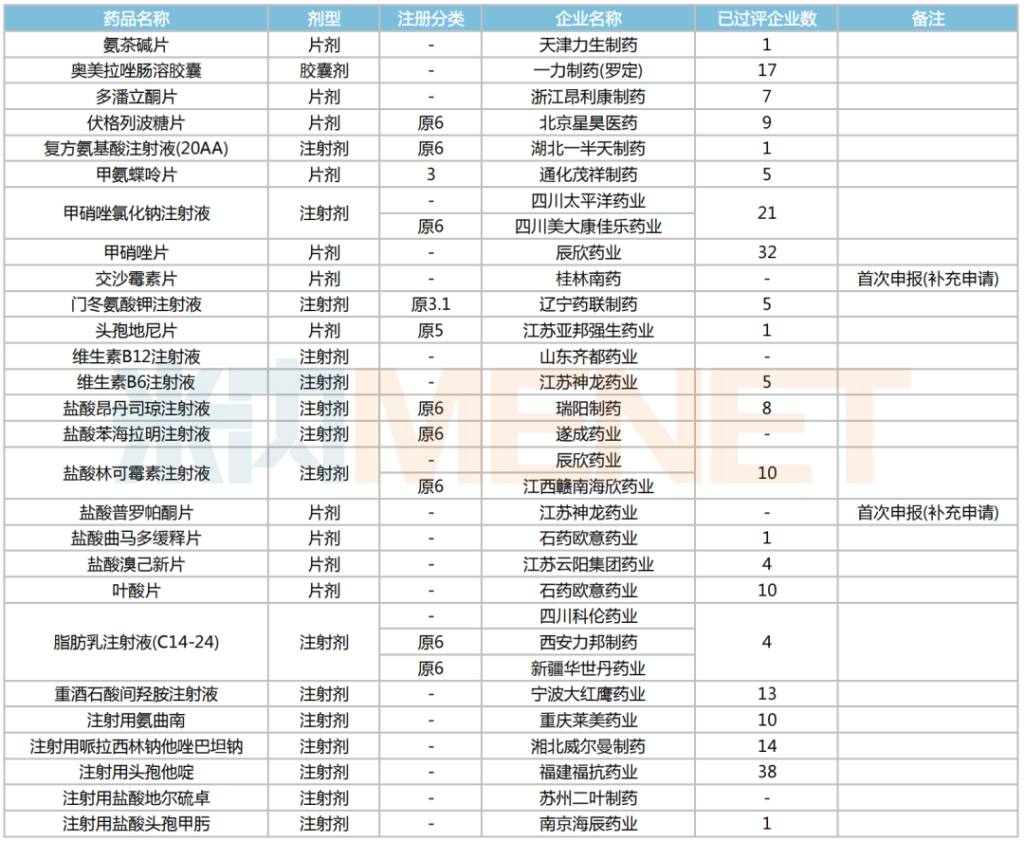
2025年2月,27個存量品種的一致性評價補充申請獲CDE承辦。交沙霉素片和鹽酸普羅帕酮片首次有企業按補充申請申報。有5個品種目前暫無企業過評,分別是交沙霉素片、維生素B12注射液、鹽酸苯海拉明注射液、鹽酸普羅帕酮片、注射用鹽酸地爾硫卓。
2025年2月一致性評價申請情況(存量品種)
數據來源:米內網中國申報進度數據庫(MED)、CDE、NMPA;相關統計字段按藥品名稱統計,申報企業數按主申報企業統計,時間截至2025年2月28日;藥物作用靶點以及適應癥整理自公開資料;首仿品種指中國內地首仿品種。
