文章來源:小藥說藥
01 引言:當(dāng)抗體遇上寡核苷酸,基因治療的“高精度快遞”
在抗體偶聯(lián)藥物(ADC)成功撬動千億腫瘤市場后,新一代抗體-寡核苷酸偶聯(lián)藥物(AOCs)正在沖破傳統(tǒng)療法的天花板。這種通過單克隆抗體精準(zhǔn)遞送基因治療載荷(如siRNA、反義RNA)的技術(shù),被視為“靶向+基因編輯”的終極組合。然而,從實驗室到臨床的征途上,AOCs的技術(shù)難點與商業(yè)化挑戰(zhàn)遠超想象。
02 AOC是誰?重新定義靶向基因治療的底層邏輯
1.?從ADC到AOC:革命性遞送平臺的升級
AOCs由單克隆抗體與寡核苷酸(ONs)通過化學(xué)連接子或生物偶聯(lián)技術(shù)結(jié)合而成,核心技術(shù)邏輯是“抗體導(dǎo)航+基因調(diào)控”。與ADC遞送小分子毒素不同,AOCs的核心價值在于將基因藥物(如siRNA)精準(zhǔn)輸送到靶細胞,通過調(diào)控致病基因表達實現(xiàn)治療。例如:Avidity Biosciences的AOC 1001是全球首款進入臨床的AOC,靶向轉(zhuǎn)鐵蛋白受體1(TfR1),遞送siRNA治療1型肌強直性營養(yǎng)不良(DM1),通過沉默異常RNA毒性實現(xiàn)病理逆轉(zhuǎn)。
2.?技術(shù)差異化:為什么AOCs是下一個十年的必爭之地?
與傳統(tǒng)基因治療載體(如病毒或脂質(zhì)納米顆粒)相比,AOCs具有雙重優(yōu)勢:
精準(zhǔn)靶向:抗體介導(dǎo)的內(nèi)吞作用可突破難以穿透的生理屏障(如血腦屏障、肌肉組織);長效持久:單抗的長半衰期大幅延長基因藥物的作用時間,減少給藥頻率。 ?Dyne Therapeutics的FORCE?平臺為例,其設(shè)計的AOCs針對肌肉細胞表面受體,通過系統(tǒng)性給藥實現(xiàn)肌肉組織特異性積累,臨床前研究顯示單次給藥可維持基因沉默效果超過3個月。
03 AOC的四大“技術(shù)命門”:偶聯(lián)工藝的精密博弈
1.?連接子技術(shù):穩(wěn)定與釋放的終極平衡
連接子需同時滿足“循環(huán)中穩(wěn)定”+“胞內(nèi)高效釋放”兩個矛盾需求。目前主流的偶聯(lián)策略包括:
化學(xué)交聯(lián)法:如硫醇-馬來酰亞胺偶聯(lián),可實現(xiàn)快速反應(yīng),但易發(fā)生隨機偶聯(lián)(如Avidity早期工藝); ? ??
無連接子法:如基于微生物轉(zhuǎn)谷氨酰胺酶(mTG)的定點偶聯(lián)(案例:Thiomab技術(shù)),可在抗體特定位點(如Fab區(qū))引入非天然氨基酸,實現(xiàn)DAR(藥物抗體比)精準(zhǔn)控制。?
2.?DAR控制:不均一性是療效與毒性的“不定時炸彈”
案例顯示,DAR>4的AOCs易因電荷過載導(dǎo)致抗體聚集,顯著影響藥代動力學(xué)。目前通過位點特異性偶聯(lián)(如Cysteine-Engineered抗體)可將DAR控制在2~4之間,但同時帶來工藝復(fù)雜性指數(shù)級上升。
3. 寡核苷酸修飾:如何在“遞送屏障”中殺出血路?
未經(jīng)修飾的siRNA易被血清核酸酶降解。已獲批siRNA藥物(如Alnylam的Onpattro)采用2′-O-甲基化+硫代磷酸骨架雙重修飾以提高穩(wěn)定性,但引入過多修飾可能削弱基因沉默效率。AOCs的設(shè)計需在化學(xué)修飾與功能活性間找到最佳平衡點。
4. 脫靶效應(yīng):抗體與寡核苷酸的雙重風(fēng)險
AOC的脫靶風(fēng)險既來自抗體的非特異性結(jié)合(如TfR1在肝、腦均有表達),也源于寡核苷酸的序列依賴性副作用。例如,Allergan?開發(fā)的針對?VEGF?受體的?siRNA?藥物AGN-745(Sirna-027)在?II?期試驗中由于脫靶效應(yīng)而停止使用。
04 CMC與工業(yè)化生產(chǎn)——從毫克級到千克級的“死亡谷
2.?分析技術(shù)滯后:難以量化的工藝“黑箱”
現(xiàn)有分析手段(如質(zhì)譜、毛細管電泳)對DAR>2的AOCs分辨率不足。此外,在進行DMPK研究時,考慮到AOC藥物偶聯(lián)寡核苷酸本身的摩爾量以及寡核苷酸系統(tǒng)循環(huán)快速清除的特征,檢測游離寡核苷酸通常需要更高靈敏度的分析平臺,特別是對于偶聯(lián)穩(wěn)定的AOC藥物。
05 臨床與商業(yè)化突破:誰在領(lǐng)跑黃金賽道?
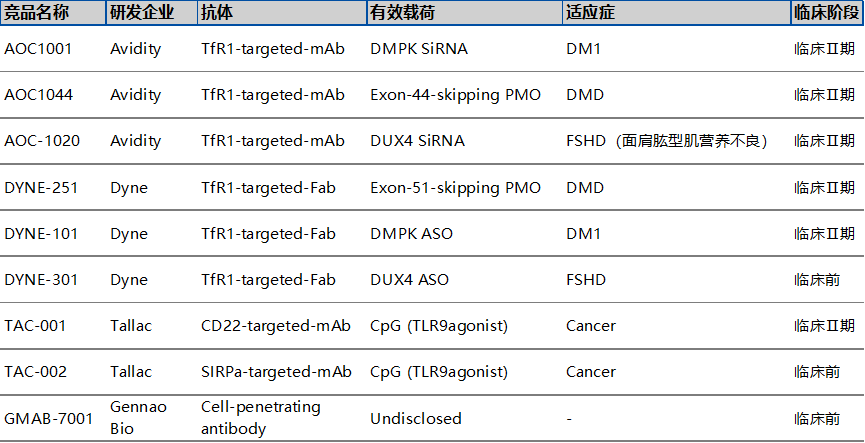
2024年3月,AOC 1001的來自MARINA開放標(biāo)簽擴展試驗(MARINA-OLE)的最新積極長期數(shù)據(jù)公布,其在治療1型強直性肌營養(yǎng)不良(DM1)的患者時,與自然疾病歷史數(shù)據(jù)相比,在多個臨床終點逆轉(zhuǎn)疾病進展。基于這些鼓舞人心的成果,AOC 1001的3期臨床試驗HARBOR已經(jīng)正式啟動,預(yù)示著Avidity Biosciences在AOC藥物領(lǐng)域的研發(fā)工作即將進入一個新的階段。
DNL310是一款由人艾杜糖-2-硫酸酯酶(IDS)與Denali的酶轉(zhuǎn)運載體(ETV)結(jié)合的ASO藥物,DNL310被設(shè)計為可以遞送IDS蛋白至包含腦部的全身細胞與組織的溶酶體中,以對GAG進行分解,從而達到治療MPS II的目的。2023年6月,公司公布了DNL310用于MPS II治療的I/II期臨床結(jié)果。數(shù)據(jù)顯示,與基線相較,MPS II患者血清中的神經(jīng)絲蛋白輕鏈(NfL)水平顯著減少達64%。目前DNL310的臨床II/III期試驗正在全球進行中。
4.?T-CpG全身給藥,實現(xiàn)靶向免疫激活Tallac開發(fā)了一種新型Toll樣受體(TLR)激動劑抗體偶聯(lián)物平臺(TRAAC)。多功能免疫激活平臺通過全身給藥提供強效的TLR9激動劑(T-CpG),以實現(xiàn)靶向免疫激活,可以誘導(dǎo)機體產(chǎn)生天然性和適應(yīng)性免疫反應(yīng),達到治療多種惡性腫瘤的目的。
TAC-001是一種全身給藥的TRAAC分子,由強效TLR9激動劑與CD22抗體結(jié)合而成,旨在選擇性地激活B細胞以驅(qū)動抗腫瘤免疫反應(yīng)。2022年7月,Tallac宣布TAC-001針對晚期實體瘤患者的1/2期研究已經(jīng)完成了首例給藥。2023年11月,Tallac首次公布了TAC-001在實體瘤患者中的1期臨床安全性和有效性數(shù)據(jù)。單藥TAC-001(0.1至3毫克/千克)耐受性良好,表現(xiàn)出與其提出的MOA一致的藥效學(xué)活性,并產(chǎn)生了初步的臨床活性,患者獲得了持久穩(wěn)定的疾病(≥6個月)和RECIST1.1標(biāo)準(zhǔn)的部分應(yīng)答。
06 結(jié)語:AOC的星辰大海與近在眼前的荊棘
AOCs的臨床價值毋庸置疑,但其工業(yè)化之路仍布滿技術(shù)深壑。從業(yè)者需在三重維度破局:工藝上開發(fā)更穩(wěn)健的定點偶聯(lián)技術(shù),分析上建立高分辨率質(zhì)控體系,臨床策略上尋求未被滿足的適應(yīng)癥(如神經(jīng)系統(tǒng)疾病)。這場關(guān)于“精準(zhǔn)遞送”的馬拉松,誰能在技術(shù)深水區(qū)率先上岸,誰將定義下一代基因治療的黃金標(biāo)準(zhǔn)。
