文章來源:DRF天然產物靶點發現
包裹在納米顆粒(PNP)中的植物分子(如外泌體樣納米顆粒(ELN))存在于多種食物,并在局部和全身調節重要的腸道微生物群活性和宿主生理系統中發揮關鍵作用。最近的研究表明,生姜來源的ELN (GELN)可以通過調節小鼠腸道乳桿菌的色氨酸代謝來緩解結腸炎,而大蒜來源的ELN優先被腸道疣微菌門攝取,從而有助于逆轉糖尿病的胰島素抵抗。鑒于PNP已從多種不同類型的可食用植物中鑒定出來,這些PNP是否以及如何可能被某些人類腸道菌群選擇性攝取,并進一步發揮調節細菌代謝產物的多樣性還有待闡明。
2025年2月3日,美國路易斯維爾大學醫學院Huang-Ge Zhang團隊在Nat Commun在線發表題為“Plant-nanoparticles enhance anti-PD-L1 efficacy by shaping human commensal microbiota metabolites”的文章。姜來源的外泌體樣納米顆粒(GELN),GELN ally – mir159a -3p通過抑制受體細菌磷脂酶C (PLC)的表達和增加二十二碳六烯酸(DHA)的積累來增強抗pd – l1治療黑色素瘤。

摘要
飲食已成為影響腸道菌群功能的關鍵因素。然而,膳食成分的復雜性使其難以預測具體結局。在本研究中,我們通過人源化小鼠模型研究了植物源納米顆粒(PNP)在癌癥免疫治療的背景下對腸道微生物群和代謝產物的影響。具體來說,我們發現姜來源的外泌體樣納米顆粒(GELN)分別由二半乳糖基二酰基甘油(DGDG)和甘氨酸介導,被毛螺菌科(Lachnospiraceae)和乳桿菌科(Lactobacillaceae)優先攝取。我們進一步證明,GELN ally – mir159a -3p通過抑制受體細菌磷脂酶C (PLC)的表達和增加二十二碳六烯酸(DHA)的積累來增強抗pd – l1治療黑色素瘤。循環中DHA水平的增加通過結合PD-L1啟動子抑制腫瘤細胞中PD-L1的表達,并隨后阻止c-myc啟動的PD-L1轉錄。與對照組相比,補充DHA的抗pd – l1無應答患者腸道細菌的無菌雄性小鼠定植可增強抗pd – l1治療的療效。我們的研究結果揭示了PNP通過調節腸道細菌代謝途徑對人類腫瘤免疫治療的一個以前未知的機制影響。
1.植物源性納米粒子(PNP)優先被特定的人類腸道細菌家族攝取
食物在通過腸道時被消化,并釋放納米大小的顆粒到腸腔。與在腸道中穩定存在的外泌體一樣,發表的結果表明,植物源性外泌體樣納米顆粒(ELN)對胃腸道酸性環境、酶和膽汁提取物表現出高耐受性。可食用納米顆粒的貨物可能通過從腸腔轉移到體循環的方式在局部腸道環境或遠處組織中發揮生物活性。本研究主要研究了可食用植物源納米顆粒(PNP)對人體腸道微生物群落生物學功能的影響。作為概念的證明,基于文獻報道,PNP可以從生姜根,大蒜,蘆薈和檸檬中分離,我們開始對從這四種植物中選擇的PNP進行表征。使用差速離心法從生姜根、大蒜、蘆薈和檸檬中提取PNP,并使用蔗糖梯度離心法純化。以10萬× g終速度離心分離ELN。隨后,我們研究了10000 × g和100000 × g離心獲得的微球中的PNP的特性,分別被稱為納米顆粒/ 10000 × g (Nano10)和外泌體樣納米顆粒/ 100000 × g (ELN)。在本研究中,包括ELNs和Nano10在內的每一種PNP都是在蔗糖梯度離心后從優勢條帶中純化和收集的。通過光散射分析測量的每種PNP的產量表明,食用植物可以作為大規模生產ELN和Nano10的來源,特別是葡萄柚和生姜,它們提供了更高的ELN和Nano10的產量。檸檬的PNP產量最低。綜上所述,這些數據表明食用植物中至少含有兩種不同特征的PNP (Nano10, ELN)。我們從小鼠腸道微生物中獲得了支持飲食在調節腸道微生物群組成和功能方面發揮作用的許多證據。然而,小鼠腸道菌群的組成與人類腸道菌群的組成不同。為了確定人類腸道細菌是否具有PNP,在知情同意的情況下,收集了15名健康受試者(25 ~ 52歲)的糞便樣本。隨后將細菌分離并混合在一起,以避免細菌種類的潛在變異。將人糞便細菌(hFB)等分物定植到無菌(GF) C57BL/6 J小鼠(hFB小鼠)(圖1A)。
接下來,為了確定PNP是否優先被特定的腸道細菌家族攝取,我們將PKH26+標記的PNP經口灌胃給hFB小鼠,然后使用熒光激活細胞分選(FACS)對PNP/PKH26+細菌進行分選(圖1A)。隨后,通過16S rRNA二代測序分析了體外和體內實驗中PNP/PKH26+細菌的組成(圖1A, B)。通過序列優化和質量篩選,每個樣本可獲得102 ~ 185 k的細菌16S rRNA基因清潔標簽。在相似性截斷值為0.03(97%)時,一個包含36 k 16S rRNA清潔標簽的子樣本給出了615個可操作分類單元(OTU)。利用基本局部比對搜索工具(Basic Local Alignment Search Tool, BLAST)將16S序列與NCBI數據庫進行比對,在各分類水平上可分為37個門、65個綱、115個目、192個科、352個屬和其他未鑒定的類群。比較體內和體外PNPs/PKH26+細菌的組成,我們的數據表明,體外PNPs/PKH26+細菌的優勢科為毛螺菌科(21.48%±5.38%),擬桿菌科(13.01%±2.40%),Coriobacteriaceae(6.99%±2.67%)和瘤胃球菌科(4.92%±2.01%)。體內實驗結果為S24.7(32.43%±11.33%,LI;21.87%±14.12%,SI), Lachnospiraceae(8.25%±4.62%,LI;6.11%±4.29%,SI)和Ruminococcaceae(5.07%±2.47%,LI;4.70%±2.97%,SI),無論來自SI還是LI(圖1B)。有趣的是,反芻動物對PNPs的攝取在體外和體內沒有差異。綜上所述,這些結果表明,PNP可以被腸道細菌攝取,除了瘤胃球菌科外,環境(體外和體內)對PNP的攝取選擇性有影響。此外,我們發現攝取效率取決于PNP的類型(ELN vs . Nano10)和用于分離PNP的植物類型(圖1B)。
然后,我們研究了PNP是否被密切相關的腸道細菌家族攝取。我們進行了主成分分析(PCA),以探索在選擇的PNP和腸道中不同位置的PNP受體細菌組成的變化(圖1C)。PCA雙標圖沿前兩個主成分捕獲了細菌組成內的大部分方差。主成分1 (PC1)解釋了39.2%的方差,而主成分2 (PC2)解釋了額外的20.5%的方差,累計覆蓋了數據總變異的59%以上(圖1C)。多變量統計PCA分析顯示,根據細菌成分(即彼此接近的細菌成分),有3個聚類(圖1C)。簇1包括大蒜的ELN和Nano10,姜的Nano10和蘆薈的ELN,它們優先被LI中相關的相似細菌攝取。簇2包括蘆薈和生姜來源的PNP,它們在SI中共享相似的受體細菌。在Cluster 3中,相似的腸道細菌在LI中優先吸收姜和檸檬來源的ELN,在SI中也優先吸收檸檬來源的ELN。為了測試細菌環境對PNP攝取的影響,我們應用主坐標分析(PCoA)在家族水平上對otu的UniFrac距離進行分析,分為體外(人類LI)和體內(小鼠LI和SI)。我們的分析表明,樣品之間的距離主要由PCoA1和PCoA2決定(圖1D)。統計分析表明,主成分1 (28.58%,p = 0.0001)和主成分2 (12.51%,p = 0.002)在這三種情況之間有顯著差異。綜上所述,我們的數據表明,膳食來源的PNP可以被人類腸道細菌選擇性攝取,并且多種因素影響細菌攝取PNP,包括PNP的類型(Nano10, ELN)、用于分離PNP的植物類型和腸道微環境。
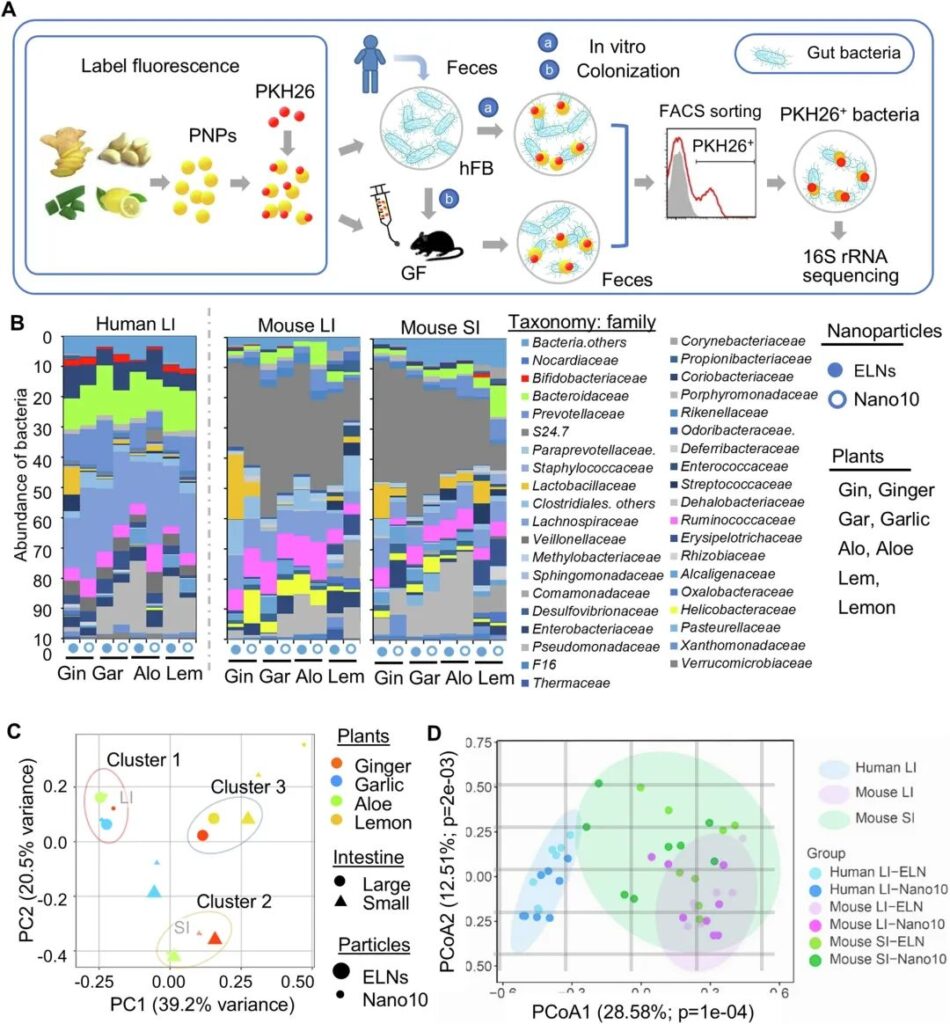
圖1:人體腸道細菌對植物來源的納米顆粒(PNP)的攝取
2.PNP脂質和氨基酸充當人類腸道細菌的“吃我”/“不要吃我”信號
飲食通過多種功能性納米顆粒在調節腸道微生物群穩態方面發揮關鍵作用36,37。新興研究和我們的數據(圖1)提示,可食用PNP可被腸道細菌通過吞噬途徑選擇性攝取,而PNP衍生因子(如脂質和氨基酸[AA])對腸道細菌攝取納米顆粒以調節腸道微生物群穩態產生正面或負面影響。此外,我們還闡明了PNP如何通過“吃我” / “不要吃我”信號被腸道細菌選擇性攝取的分子機制。我們之前的研究表明,在小鼠腸道中,乳酸桿菌科優先被GELN攝取,這歸因于GELN4中高度富集的磷脂酸(PA)。然而,一般而言,PNP脂質是否在腸道細菌的選擇性攝取中發揮致病作用尚不清楚。為了確定PNP的脂質作用,我們使用三重四極桿質譜(MS)進行脂質組學分析,確定了從補充表6中列出的PNP提取的脂質和脂質組成。我們列出了從4種不同類型的植物中分離出的ELN和Nano10的組成(圖2a)。Kruskal-Wallis H檢驗和小提琴分析表明,ELN和Nano10之間的脂質組成存在顯著差異(p = 1e-09),具體來說,PA在ELN中富集,而溶磷脂酰甘油(lysoPG)和二半乳糖基二酰基甘油(DGDG)在Nano10中富集,而與PNP衍生的植物類型無關(圖2B)。脂質譜的PCA圖進一步揭示了大蒜PNP和檸檬PNP的整體脂質成分更相似,因為與其他類型植物的PNP相比,它們在PCA圖上更接近(圖2C)。相比之下,生姜、蘆薈和大蒜中eln衍生的脂質的組成與它們的Nano10不同,這表明了更多的變異(圖2C)。
接下來,我們確定了PNP衍生因子是否可以作為“吃我”/“不要吃我”的信號,使PNP被腸道細菌選擇性攝取。我們發表的數據表明,富含pa的生姜ELN有助于乳酸桿菌的吸收。然而,雖然AELN具有高水平的PA(圖2A),但乳桿菌科卻只占據了很少的蘆薈- eln(圖1B),這表明PNP中的多個因素可能作為介導腸道細菌攝取的信號。鑒于納米顆粒膜由多種功能因子組成,包括脂質、核酸和蛋白質/AAs,并且發現aa被細菌選擇性攝取,我們假設除了脂質外,PNP膜上的aa也作為“吃我”/“不吃我”信號。為了闡明我們的假設,我們首先使用MS分析評估了PNP膜上所有20個aa的組成。我們發現,與其他AAs相比,PNP膜上的組氨酸、色氨酸、纈氨酸、亮氨酸、精氨酸和脯氨酸水平較高(圖2d)。與Nano10相比,ELN膜上的AAs水平總體較高。具體來說,GELN和姜納米10含有相對較高水平的甘氨酸,而大蒜PNP含有相對較高水平的苯丙氨酸和半胱氨酸(圖2D)。采用主成分分析(PCA)探討不同PNPs間aa成分的差異。PCA雙標圖(圖2E)沿著前兩個主成分捕獲了AAs輪廓中80%以上的方差。主成分1 (PC1)解釋了62.9%的方差,而主成分2 (PC2)解釋了額外的20%的方差。來自檸檬、蘆薈和生姜的Nano10具有共同的aa分布,因為它們在PCA圖上相互靠近。只有蘆薈在其ELN和Nano10上具有類似的AAs組成(圖2E)。
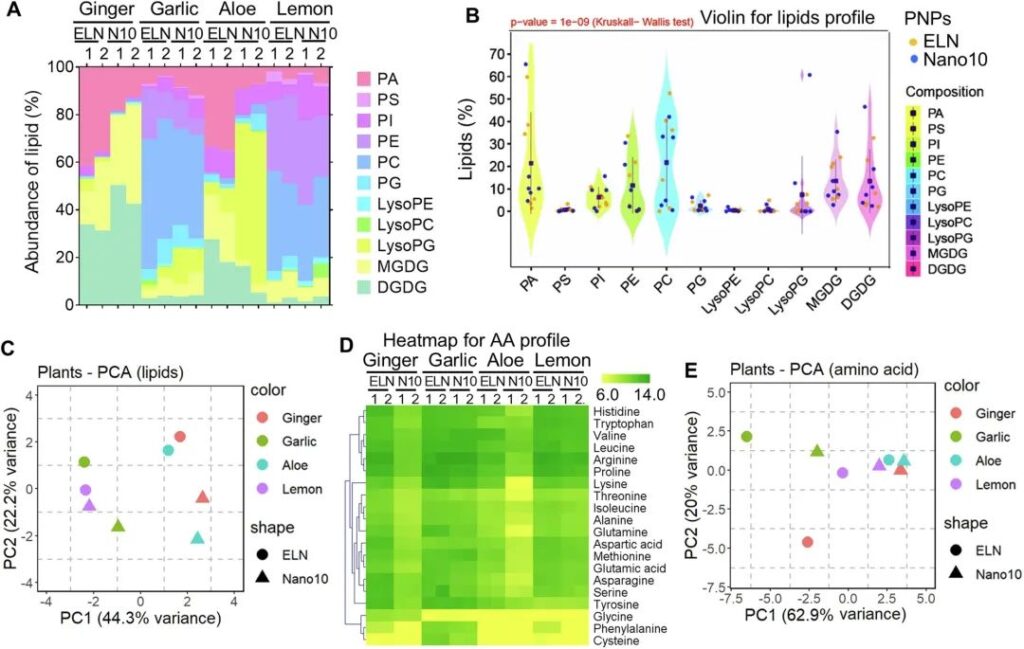
圖2:PNP脂質和氨基酸組成分析
采用Spearman相關系數分析PNP中脂質和aa的相對組成與細菌攝取的相關性,探討PNP中脂質和aa是否可以作為“吃我” / “不吃我”的信號來促進/阻止腸道細菌攝取。我們使用K-Means聚類方法42的聚類熱圖來顯示不同腸道位置(圖3A)和綜合多個位置的相關系數與這些相關性的模式。紅色和藍色分別表示各腸道細菌分類科與PNP脂質/ aa含量的正相關和負相關系數。生成了火山圖(圖3B, C),以顯示關聯相對于相關系數的統計顯著性。這些圖作為PNP脂質(圖3B)/PNP aa(圖3C)和細菌豐度之間相關性的可視化表示。使用0.05的p值閾值對火山圖進行分層,以突出統計學顯著相關性。除了圖表(圖3B, C),我們還列出了基于p值排序的前10個相關性(圖3B, C),例如,富含脂質單半乳糖基二酰基甘油(MGDG)的PNP作為“吃我”信號,用于乳桿菌優先攝取,而富含磷脂酰肌醇(PI)的PNP作為“不要吃我”信號,用于阻止乳桿菌攝取。乳桿菌科也優先攝取富含甘氨酸的PNP,而纈氨酸可抑制Ruminococcaceae和Lachnospirascease對PNP的攝取。
為了驗證我們的相關性分析,表明PNP的脂質可以增強/抑制腸道細菌的攝取,我們用特定種類的細菌進行了攝取試驗。由于特定種類的細菌可在市場上獲得,我們使用了產氣莢膜梭菌(C. perf) (Lachnospirascease家族的一種)和羅伊乳桿菌(L. reuteri)(乳桿菌科的一種)來測試我們的脂質相關性結果。我們隨機選取了DGDG(“吃我”)和PI(“不要吃我”),因為Lachnospirascease家族優先攝取DGDG富集的GELN,而PI富集的AELN抑制乳桿菌科對AELN的攝取(圖3A-C)。為了測試PNP脂質是否介導細菌的攝取,我們分別從GELN和AELN的總脂質中去除DGDG和PI 4,剩余的脂質通過超聲處理重新組裝成納米大小的納米囊泡(NV),分別稱為姜NV(GNV)和蘆薈NV(ANV)。FACS分析表明,受體細菌對GELN和GNV、AELN和ANV的攝取效率相似(圖3D)。此外,從GNV脂質中去除DGDG顯著降低了穿孔念珠菌對GNV的攝取,而添加DGDG則恢復了對GNV的攝取(圖3D,左面板)。相反,PI的消耗促進了L. reuteri對ANV的攝取,而PI的添加恢復了對ANV攝取的抑制作用(圖3D,右圖)。
為了驗證AAs對PNP是否具有促進/抑制腸道細菌攝取的作用,我們對特定種類的細菌進行了攝取實驗。由于特定種類的細菌,乳桿菌科的一種羅伊乳桿菌(L. reuteri)和瘤胃球菌科的一種bromii瘤胃球菌(R. bromii)被用于檢驗我們的aa相關性結果。我們隨機選取了甘氨酸(“吃我”)和纈氨酸(“不要吃我”),因為GELN甘氨酸促進乳桿菌科對GELN的攝取,纈氨酸抑制瘤胃球菌科對GELN的攝取(圖3A-C)。為了證實我們的AAs相關性結果,我們分別用甘氨酸和纈氨酸預孵育羅伊氏乳桿菌和溴代雷氏乳桿菌。FACS分析表明,預孵育游離形式的甘氨酸抑制羅伊氏乳桿菌對GELN的攝取,而預孵育游離形式的纈氨酸促進溴代雷氏乳桿菌對GELN的攝取(圖3E,左圖)。用甘氨酸脫氫酶(GLDC)從GELN中去除甘氨酸可減少羅伊氏乳桿菌對GELN的攝取,而用纈氨酸脫氫酶(VDH)從GELN中去除纈氨酸可誘導溴代雷公藤對GELN的攝取(圖3E,右)。這些結果也與相關分析一致,提示pnp衍生的多種因素,包括脂質和AA,可以作為“吃我”/“不要吃我”的信號,以增強/抑制人體腸道細菌的攝取。不同類型的食用植物含有多種PNP,且每種PNP都有其獨特的脂質和aa組成,我們的數據表明,PNP上特定的脂質和aa譜可以通過選擇性地增強/抑制腸道細菌對PNP的攝取來調節腸道菌群的穩態。
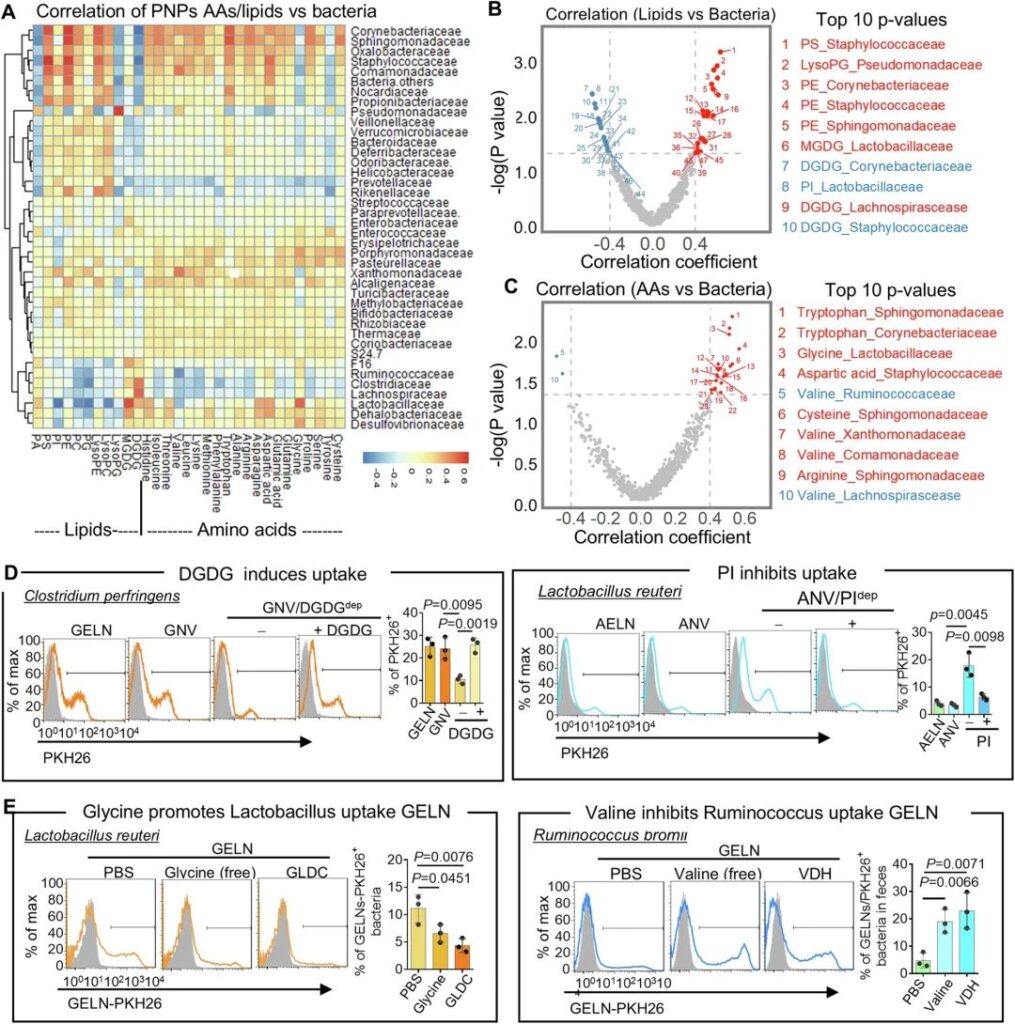
圖3:腸道細菌優先攝取與PNP脂質和氨基酸組成的相關性分析
3.PNP通過改變人體腸道細菌的代謝產物來調節細胞代謝途徑
為了專注于細菌代謝物并排除宿主代謝物的影響,GF小鼠的LC-MS/MS數據經過標準化處理后代表了細菌代謝物的改變。熱圖分析顯示,PNP調節了上調和下調的腸道細菌代謝物。數據表明,來自生姜(圖4A)、大蒜(圖4B)、蘆薈(圖4C)和檸檬(圖4D)的PNP對細菌代謝產物水平的影響取決于PNP的類型和腸道微環境。例如,來自同一類型植物的ELN和Nano10具有不同的作用。氨基丁酸(GABA)在eln處理的腸道細菌代謝產物中高度富集,但在nano10處理的細菌中沒有。在SI中,GELN顯著誘導了腸道細菌來源的不飽和脂肪酸(USF),包括二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),但在LI中沒有,也沒有被Nano10或其他植物來源的PNP誘導(圖4A)。這一結果表明,腸道微環境影響PNP介導的對人體腸道菌群代謝產物產生的調節。

圖4:通過代謝組學分析PNP對腸道細菌代謝物的影響
接下來,我們試圖訪問基于人類代謝的通路,這些通路可能受到PNP調節的人類腸道細菌衍生代謝物的調節。為了確定哪些代謝通路在ELN和Nano10處理后發生了改變,我們使用了KEGG代謝組學數據庫。利用最新的KEGG代謝組學數據庫,我們發現腸道細菌的166個差異代謝物受到ELN和Nano10的影響,并與人類代謝通路相關。代謝通路在散點圖中可視化(圖5A)。代謝途徑的相對影響通過代謝途徑中所有代謝物的變化倍數來估計,如圖5A所示。更具體地說,結果表明,LI的代謝產物對ELN處理的丙氨酸,天冬氨酸,谷氨酸(AAG)途徑有顯著影響,而三羧酸(TCA)循環途徑受到Nano10的影響,無論植物類型。有趣的是,在SI中,AAG和TCA通路都受到姜和大蒜來源的PNP的高度影響。然而,蘆薈ELN和檸檬ELN分別對TCA和AAG通路沒有影響,而生姜ELN在SI中顯著上調USF通路。熱圖(圖5B)表明,d -谷氨酰胺和d -谷氨酸(DGG)、精氨酸和脯氨酸(ARP)以及牛磺酸和次牛磺酸(THT)途徑的活性被所有4種ELNs增強,而這些途徑的活性被所有4種Nano10消除。相反,四種eln均可降低谷胱甘肽(GTA)活性,而四種Nano10均可提高GTA活性。這種變化不可能是由于用于治療hFB小鼠的納米粒子的量的變化,因為無論哪種類型的納米粒子用于治療小鼠,在ANS, ASC和GPL活性方面沒有差異。此外,我們注意到,PNP處理后,生物素代謝(BIO)通路僅在小鼠的LI中發生改變,而包括BAL、AAT、MTB、USF、HIT和PTG在內的多條通路在SI中發生改變(圖5B)。綜上所述,這些數據表明,ELN和Nano10可能通過作用于腸道細菌釋放的代謝物來調節人體代謝通路的穩態,如DGG和THT通路。
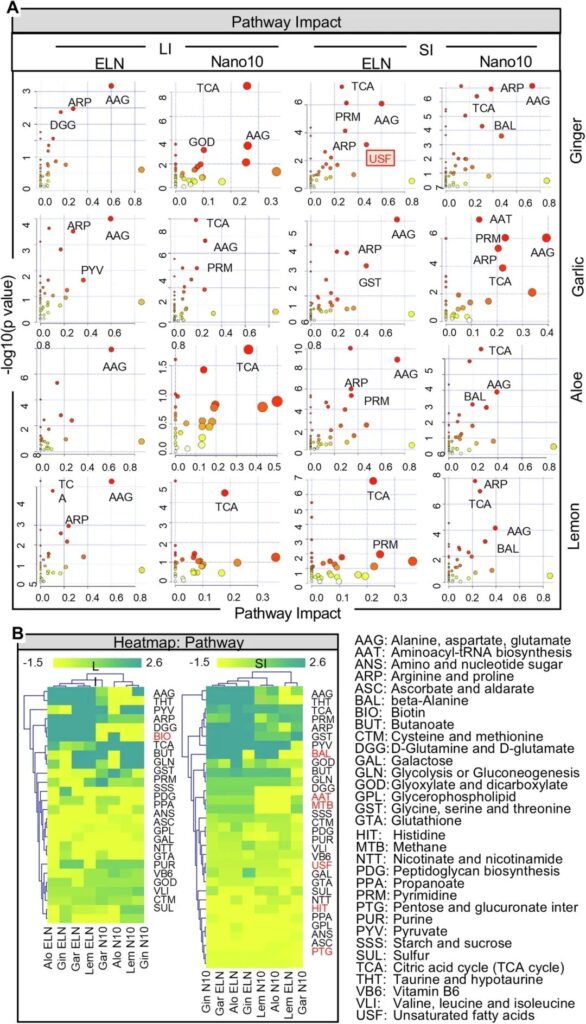
圖5:pnp介導的細菌代謝產物對宿主代謝通路的影響
4.在小鼠模型中,GELN rna通過抑制黑色素瘤生長和轉移來調節腸道細菌代謝活性
接下來,我們確定了通過PNP塑造腸道細菌代謝物是否有利于治療與生態失調相關的疾病。由于患者微生物組的異質性,免疫治療僅使一部分患者獲益,因此我們利用抗黑色素瘤生長和轉移的免疫檢查點抑制劑PD-L1進一步檢驗了我們的假設,即PNP可增強靶向腸道微生物組的PNP介導的基于抗PD-L1的免疫治療。hFB定植的雄性小鼠經口灌胃給予PNP 1個月,然后從糞便上清液中收集腸道代謝物(PNP- sup)。將B16F10黑色素瘤細胞皮下注射到hFB小鼠體內。接種7天后,我們通過腹腔(IP)注射方式將抗pd – l1 mAb (Bioxcell BE0101, 10 mg/kg,體重)以及PNP或PNP- sup給藥至攜帶黑色素瘤B16F10的小鼠(圖6A)。我們發現,生姜來源的ELN (GELN)或GELN- sup顯著增強了抗pd – l1治療對B16F10黑色素瘤生長(圖6B,頂部圖)和肺轉移(圖6B,底部圖)的抑制作用。
鑒于小rna在ELN中占主導地位,我們使用了一個無序的miRNA作為對照。我們的結果表明,GNV-RNA和GNV-RNA喂養的hFB小鼠的腸道代謝物(GNV-RNA -sup)在增強抗pd – l1介導的抗B16F10黑色素瘤進展效應方面表現出相似的作用(圖6C)。沒有證據表明gnv – rna增強了抗pd – l1介導的抗B16F10黑色素瘤治療,但喂食無特定病原體(SPF) hFB小鼠的gnv – rna產生的腸道代謝物恢復了gnv – rna介導的抗pd – l1治療增強對黑色素瘤生長和肺轉移的活性(圖6D)。比較研究提示GNV-RNAs可改善抗pd – l1治療對黑色素瘤肺轉移的療效(圖6E),并延長hFB小鼠的生存期(圖6F),但對GF小鼠無影響。綜上所述,這些數據表明GNV-RNA通過腸道微生物代謝物增強PD-L1免疫治療對抗黑色素瘤進展。
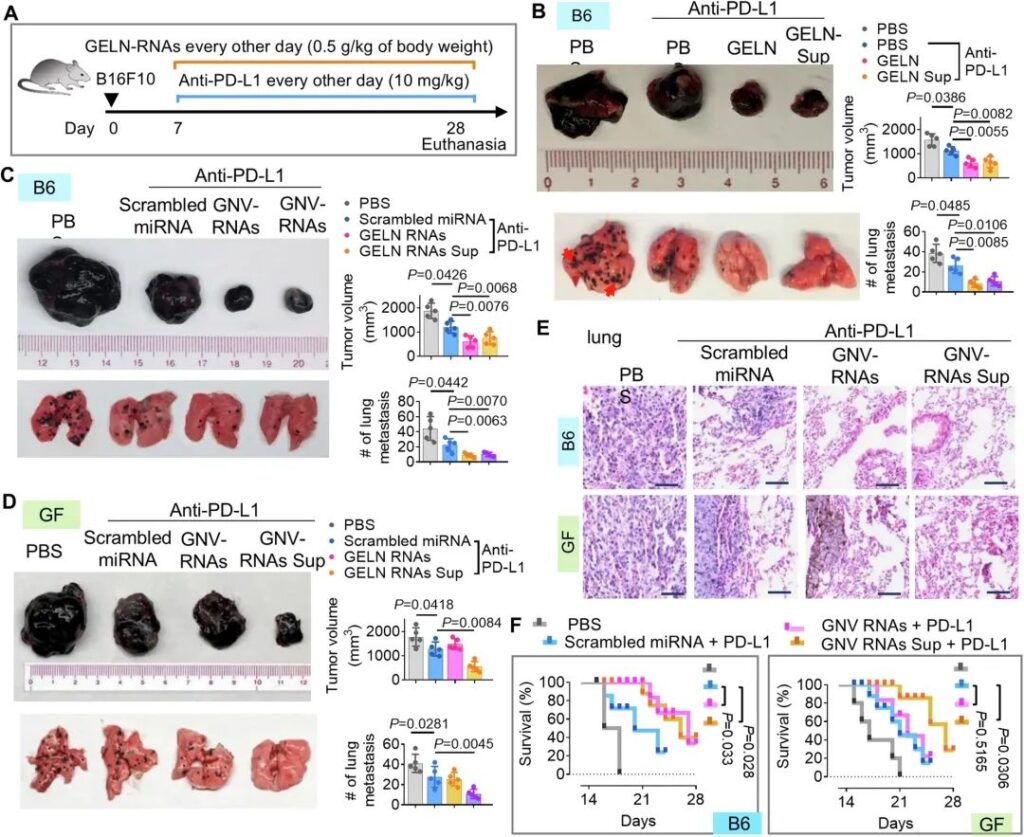
圖6:姜- eln (GELN)通過腸道代謝物提高抗黑色素瘤PD-L1抗體的效果
5.GELN aly-miR159a-3p靶向細菌磷脂酶C (PLC)導致DHA蓄積
在LC-MS/MS分析中觀察到在geln處理的hFB小鼠的SI中顯著誘導EPA及其代謝產物DHA,而在GF小鼠中未觀察到這一事實(圖4A),進一步促使我們研究不飽和脂肪酸EPA和DHA是否有助于GELN-RNA增強抗pd – l1免疫治療的分子機制。采用個體高效液相色譜法(HPLC)對LC-MS分析進行驗證。正如預期的那樣,EPA和DHA是由GELN特異性誘導的,而不是其他PNP。這一結果在hFB小鼠中再現,但在GF小鼠中未再現(圖7A)。HPLC分析還表明,被包裹到GNV中的GELN-RNA (GNV- rna)在hFB小鼠腸道中顯著誘導了DHA和EPA,但在GF小鼠腸道中沒有(圖7B)。相比之下,來自大蒜、蘆薈和檸檬的NV-RNA混合物(NV-RNAMix)對腸道糞便和外周血中的EPA和DHA無影響(圖7)。鑒于Lachnospirascease是由GELN的DGDG介導的GELN的主要靶向細菌之一(圖1A)(圖3D),我們利用Lachnospirascease家族中的一種c.p erf來檢驗我們的假設,即lachnospirasase對GELN- rna的攝取導致EPA和DHA的誘導,從而有助于增強抗pd – l1免疫治療。用高效液相色譜法測定了穿孔C. perf培養基中DHA和EPA的含量。我們發現DHA和EPA是由GNV-RNA而不是NV-RNAMix誘導的(圖7B)。接下來,我們試圖確定GELN-RNA誘導DHA和EPA產生的潛在機制。利用我們之前在NCBI GEO數據庫中發表的GELN- rna測序數據(accession, GSE153126),將高豐度的GELN- rna mirna序列(圖7C)從NCBI RefSeq數據庫(ftp://ftp.ncbi.nlm.nih.gov/genomes/refseq/bacteria/)輸入細菌基因組數據庫,搜索GELN mirna的潛在靶點。利用BLAST對核苷酸序列進行的比對表明,GELN miRNA aly-miR159a-3p可能通過兩個7-mer長度的反向補體序列靶向磷脂酶C (PLC)(圖7D),這些反向補體序列包含一個可能催化DHA生成4-oxo-DHA和4-HDHA46,47)(圖7E)。為了進一步闡明GELN ally – mir159a是否抑制梭狀芽孢桿菌目中PLC的表達,染色質免疫沉淀(ChIP)實驗也表明,PLC DNA可以被aly-miR159a-3p C. perf(圖7F,左圖)和小鼠糞便(圖7F,右圖)拉下,但不能被aly-miR159a-3p突變體拉下。對經aly-miR159a-3p處理的c.p erf進行的qPCR(圖7G)和western blot(圖7H)分析表明,PLC編碼基因的表達確實分別在轉錄和翻譯水平受到抑制。對細菌培養基的HPLC分析表明,aly-miR159a處理導致DHA誘導和4-oxo-DHA減少,但對EPA無影響(圖7I)。GELN aly-miR159a-3p可抑制PLC的表達。PLC可以代謝DHA為4-oxo-DHA,因此,抑制PLC的表達導致DHA在穿孔C. perf中累積(圖7E)。為了進一步驗證PLC對DHA代謝的作用,我們從穿孔C. perf基因組中敲除了編碼PLC的基因(KO)(圖7J),并使用融合pcr驅動的重疊延伸(overlap extension48,49)替換為氨芐西林耐藥序列。PLC KO導致穿孔C. perf中DHA水平顯著增加,4-oxo-DHA水平顯著降低(圖7K)。在PLC缺陷的C. perf中,aly-miR-159a-3p不再影響DHA和4-oxo-DHA水平(圖7K)。
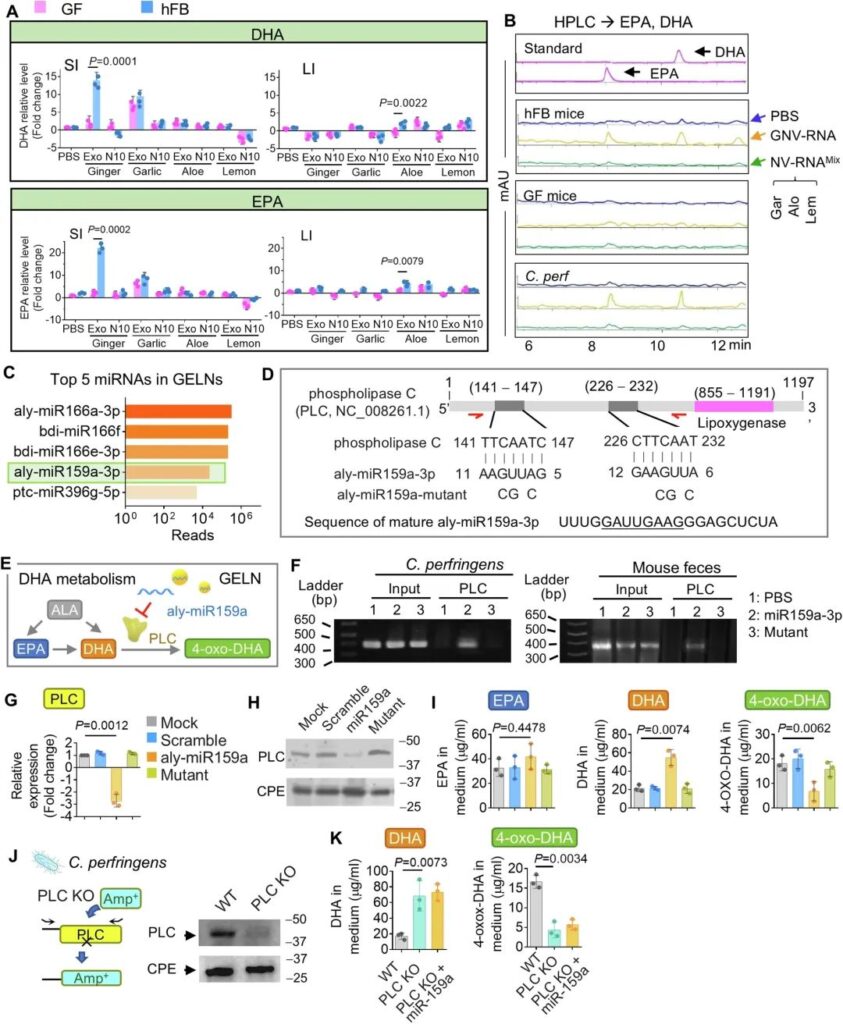
圖7:富集了aly-miR159a-3p的geln通過靶向PLC調控細菌中DHA的代謝
6.DHA增強黑色素瘤抗pd – l1免疫治療的療效
為了進一步確定DHA是否在增強抗PD-L1治療對抗黑色素瘤進展中發揮致病作用,B16F10黑色素瘤荷瘤小鼠接受了1個月的PD-L1 Ab(含/不含DHA或EPA)治療。結果表明,DHA和EPA均提高了PD-L1 Ab對黑色素瘤生長(圖8A,頂部圖)和肺轉移(圖8A,底部圖)的效果,并延長了小鼠的生存期(圖8B)。通過qPCR(圖8C)和western blot(圖8D)分析腫瘤組織中PD-L1的表達,我們發現這兩種代謝物分別在mRNA和蛋白水平上抑制PD-L1的表達。暴露于DHA的B16F10細胞以DHA劑量依賴性方式導致PD-L1表達降低(圖8E)。
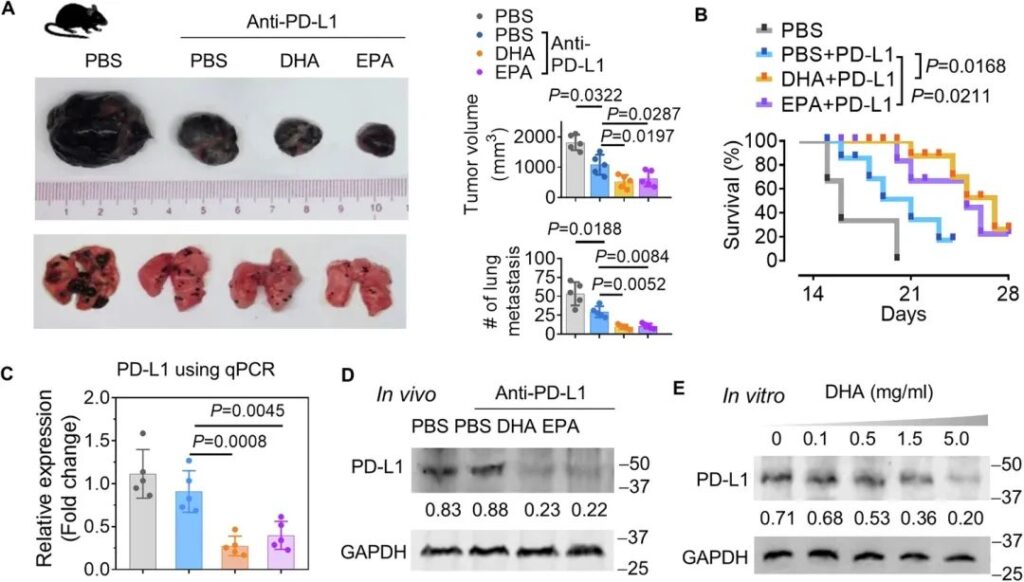
圖8:DHA通過減少腫瘤細胞中PD-L1的表達來提高抗黑色素瘤的PD-L1抗體的有效性
鑒于DHA抑制PD-L1表達,并且PD-L1水平代表了抗PD-L1免疫治療應答的潛在生物標志物,我們下一步研究臨床腫瘤樣本中的DHA和PD-L1水平是否與治療應答相關。對61例福爾馬林固定石蠟包埋的黑素瘤存檔標本中PD-L1的表達進行分析,其中PD-L1反應組35例,PD-L1無反應組26例。行PD-L1免疫組織化學(IHC)后,對每例標本進行掃描,并采用計算機輔助方法對PD-L1表達進行評分。結果表明,與癌旁正常組織相比,黑色素瘤組織中PD-L1信號的強度(圖9A,左側IHC面板)和PD-L1+細胞的百分比(圖9A,右側條形圖面板)明顯增加,免疫治療無應答患者的腫瘤組織中PD-L1的表達高于應答患者的腫瘤組織。為了進一步證實這些發現,我們采用定量方法評估了樣本中PD-L1的表達。qPCR(圖9B)、ELISA(圖9C)和免疫印跡(圖9D)的結果一致表明,與有應答的腫瘤相比,無應答的腫瘤表現出更高的PD-L1水平,無應答的腫瘤組織有更多的PD-L1 mRNA和蛋白。相反,HPLC分析表明,與鄰近的非腫瘤組織相比,腫瘤中的DHA降低,并且與治療有效的黑色素瘤患者相比,治療無效患者腫瘤中的DHA降低(圖9E)。受試者的腸道中也發現了DHA的這種減少(圖9F)。PD-L1與DHA呈負相關(R2 = 0.86 ~ 0.97)。
為了評估人類腸道細菌在免疫治療應答中的作用,我們從對PD-L1治療有應答和無應答的受試者中分離出腸道細菌。PLC是DHA代謝成4-oxo-DHA所必需的,而4-oxo-DHA有助于癌癥的發生和發展。通過qPCR測定PLC的表達,并表明來自無應答受試者的細菌中的PLC高于來自應答受試者的細菌(圖9G)。然后,將應答和無應答受試者的細菌定植于GF小鼠(圖9H)。我們發現,來自應答受試者的共生細菌(BacResp),而非來自無應答受試者的共生細菌(BacNon),通過抑制腫瘤生長(圖9I,頂部圖)和肺轉移(圖9I,底部圖),以及延長小鼠生存期(圖9J),顯著改善了抗pd – l1免疫治療。BacNon提供的DHA和BacResp同樣可以提高免疫治療的效率,這進一步表明腸道細菌的DHA通過DHA介導的抑制腫瘤細胞中PD-L1的表達在提高抗PD-L1免疫治療中起著致病作用。考慮到PD-L1與PD-1的結合會干擾T細胞(尤其是CD8+亞群)的抗腫瘤應答和增殖,我們接下來評估了CD8+腫瘤浸潤淋巴細胞中的腫瘤特異性干擾素-γ (IFNγ)水平。在FACS分析中,對CD8+PD-1+細胞進行了門控,結果表明BacResp和DHA均顯著促進CD8+PD-1+ T細胞的IFNγ生成(圖9K),并減少細胞凋亡(Annexin V+7-AAD -)(圖9L),而BacNon無此作用。鑒于天然的和經過工程改造的PNPs通常被局部免疫細胞(如單核細胞/巨噬細胞)攝取,我們測試了GELNs是否靶向并影響腫瘤浸潤免疫細胞的免疫應答。
總之,我們的數據提示,抗pd – l1無應答患者的腸道細菌表現出高水平的PLC活性。高水平的PLC活性又加速了DHA的代謝,促進腫瘤中PD-L1的表達,導致T細胞的抗腫瘤活性和生存能力受損。在無應答小鼠中,給予BacResp或DHA可增強腫瘤浸潤T細胞的抗腫瘤活性,并提高抗pd – l1免疫治療的療效。
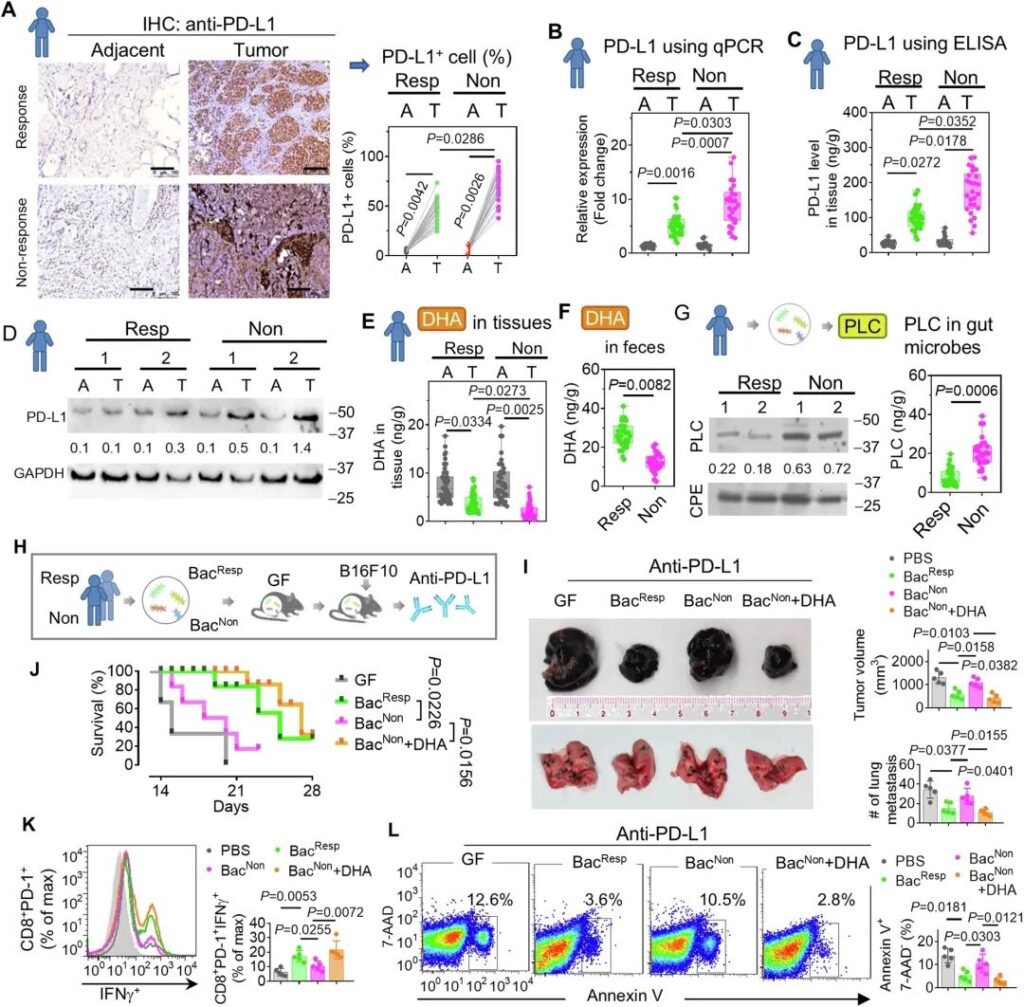
圖9:在黑色素瘤患者中,PLC的誘導減輕了導致抗pd – l1免疫治療無應答的DHA水平
7.DHA通過與PD-L1啟動子區結合的表觀遺傳效應抑制PD-L1的表達
非變性聚丙烯酰胺凝膠電泳(PAGE)分析后,將12個DNA寡聚體(PD-L1p1到PD-L1p12,每個2μM)與DHA(10μM)孵育(圖10A)。正如預期的那樣,SSGS檢測表明,只有寡聚PD-L1p9 (TSS上游- 380 ~ – 321)的遷移率被DHA而非EPA改變(圖10B),這表明DHA而非EPA與PD-L1的啟動子區結合。為了確定DHA與PD-1L啟動子的準確結合位點,我們使用覆蓋PD-L1p9全序列的短寡核苷酸(PD-L1p9A到PD-L1p9F,每個20 mer)和每個寡核苷酸的重疊序列來測試遷移率的變化。只有寡聚體PD-L1p9C發生了位移(圖10C),這表明PD-L1p9C的序列包含一個潛在的與代謝產物DHA結合的必要序列。來自hFB定植小鼠的腸道上清,以及來自geln處理的小鼠的腸道上清,重新建立了寡核苷酸PD-L1p9C遷移率的改變(圖10D)。寡核苷酸PD-L1p9C的突變消除了遷移率的改變(圖10D)。為了進一步驗證DHA和寡聚體PD-L1p9C的動態相互作用,我們接下來進行了表面等離子體共振(SPR)分析,這是一種檢測兩種不同分子相互作用的光學技術。在該技術中,生物素標記的寡聚體被固定在鏈親和素傳感器芯片上,而DHA通過SPR儀器的流式細胞儀進行接觸。SPR檢測結果表明,DHA與生物素標記的(Bio-) PD-L1p9C結合,但不與突變的(Bio-) PD-L1p9C (PD-L1p9C- mut)結合(圖10E)。這一結果與SSGS檢測結果一致。為了進一步確定DHA與PD-L1啟動子的結合是否會改變PD-L1啟動子的活性,我們將小鼠PD-L1啟動子序列引入Gaussia熒光素酶報告基因(pEZX-mPDL1, GeneCopoeia)。以DHA結合序列修飾的突變體(pEZX-mPDL1-Mut)作為對照。熒光素酶實驗表明,DHA抑制轉染pEZX-mPDL1的細胞的熒光素酶活性,但不抑制突變體(圖10F)。為了進一步揭示DHA結合所需的特定DNA基序,我們合成了20 mer長度的含有潛在DHA結合基序的DNA寡核苷酸。在20個寡核苷酸中,每個寡核苷酸含有1個突變堿基。我們假設,如果必需堿基被取代,寡核苷酸的DHA結合活性將降低。正如預期的那樣,SSGS分析提示,PD-L1 TSS上游的- 341 ~ – 358序列AGCCT……ATCAGC是DHA結合所必需的(圖10G)。多重序列比對表明,這一PD-L1結合基序在人類和小鼠中是保守的序列,兩者在PD-L1基因的啟動子區都共享這一共有序列(圖10H)。
更有趣的是,使用PROMO 3.0對轉錄因子結合位點的預測(http://alggen.lsi.upc.edu)表明,小鼠和人類PD-L1啟動子在DHA結合位點附近都有一個c-myc結合基序(CCAGGTG)(圖10H)。使用含有小鼠(pEZX-mPDL1)和人(pEZX-hPDL1) PD-L1啟動子序列的報告基因進行的熒光素酶實驗表明,在轉染pEZX-mPDL1和pEZX-hPDL1的細胞中,c-myc缺陷取消了dha介導的熒光素酶活性抑制(圖10I)。重組c-myc與pEZX-mPDL1或pEZX-hPDL1共轉染可恢復DHA抑制活性。這些數據表明,細菌代謝物DHA通過抑制c-myc介導的腫瘤細胞PD-L1表達誘導,增強抗PD-L1免疫治療的療效。
為了進一步確定DHA和PD-L1啟動子之間的分子結合位點和結構,我們使用Mfold測試了含有DHA靶向序列的小鼠和人PD-L1啟動子序列的二級結構(圖10H),然后使用HDOCK服務器(http://hdock.phys.hust.edu.cn/)分析對接。利用UCSF Chimera58分析的潛在分子相互作用模式表明,DHA和PD-L1啟動子之間通過G-4 (m)和G-11 (h)位置的氫鍵相互作用,發生的對接分數為-39.98,配體rmsd (?)為19.83(圖10J)。對SPR的進一步分析表明,DHA抑制c-myc作為轉錄因子募集到PD-L1的啟動子(圖10K)。試管實驗進一步證實了DHA與PD-L1啟動子區相互作用的結果。B16F10黑色素瘤細胞用腸道上清液和生物素標記(Bio)-PD-L1p9C (Bio- wt)或Bio- s100p1 – g突變體(Bio- mutant)處理6小時,并用鏈霉親和素珠從細胞裂解液中拉出復合物,用于定量分析代謝物。LC-MS結果表明DHA被PD-L1p9C募集到復合物中,而不是被突變體募集(圖10L)。
綜上所述,這些數據表明DHA通過表觀遺傳效應抑制小鼠和人PD-L1在黑色素瘤細胞中的表達。腸道DHA水平和PD-L1表達呈負相關進一步證明了DHA增強抗PD-L1治療的生物學效應。
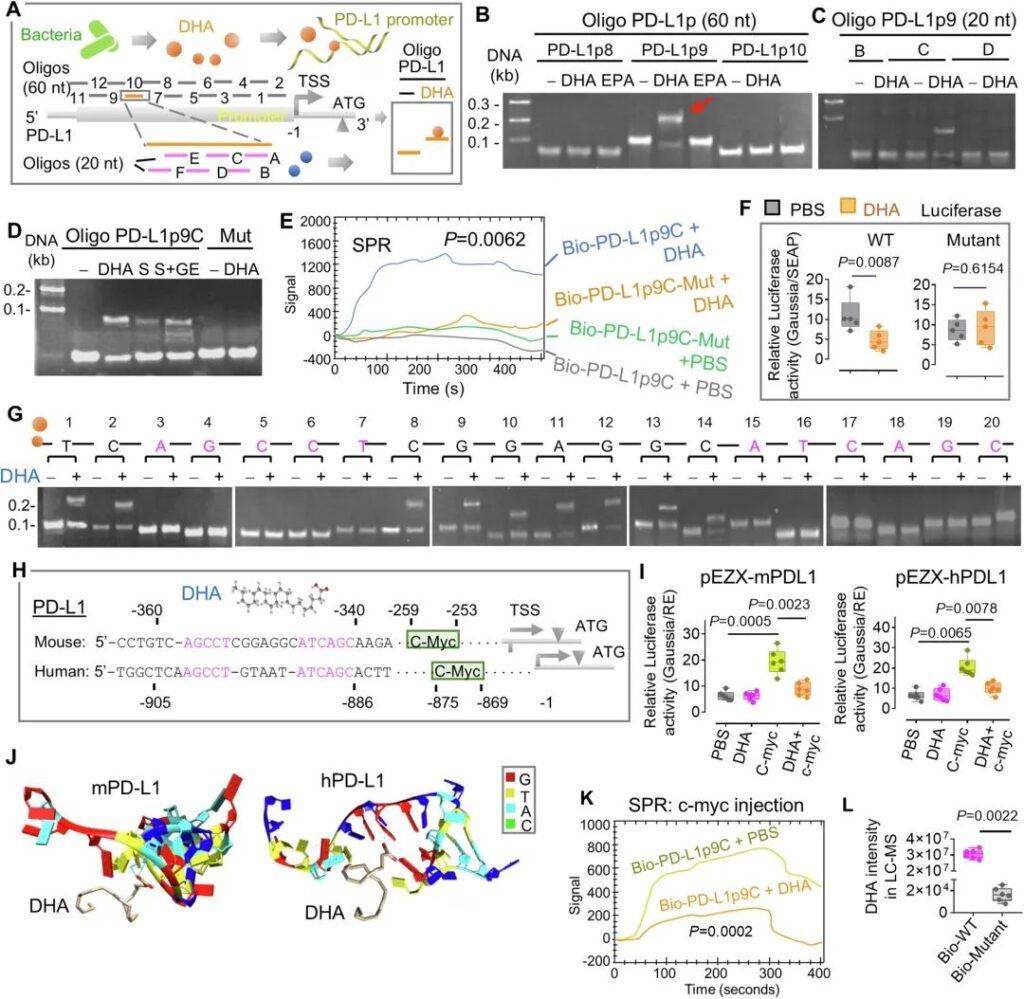
圖10:DHA干擾轉錄因子c-myc對PD-L1啟動子的訪問
結論
姜來源的外泌體樣納米顆粒GELN可以通過靶向人類腸道共生菌群的不飽和脂肪酸代謝通路來增強黑色素瘤抗pd – l1治療的療效。這一創新策略通過將天然化合物與先進的免疫療法相結合,為提高癌癥治療效果開辟了新的途徑。
Teng Y, Luo C, Qiu X, Mu J, Sriwastva MK, Xu Q, Liu M, Hu X, Xu F, Zhang L, Park JW, Hwang JY, Kong M, Liu Z, Zhang X, Xu R, Yan J, Merchant ML, McClain CJ, Zhang HG. Plant-nanoparticles enhance anti-PD-L1 efficacy by shaping human commensal microbiota metabolites. Nat Commun. 2025 Feb 3;16(1):1295. doi: 10.1038/s41467-025-56498-2.
