文章來源:藥智新聞
導讀:2025年1月,藥智網收錄整理的國家藥監局發文政策25條
本月國家部委發文政策情況
2025年1月,藥智網收錄整理的國家藥監局發文政策25條;國家藥審中心發文政策12條;國家醫保局發文政策11條;國家衛健委發文政策16條;醫療器械技術審評中心發文政策5條;國家藥監局食品藥品審查核驗中心發文政策3條;國家藥典委員會發文政策3條;國家市場監督管理局發文政策5條。
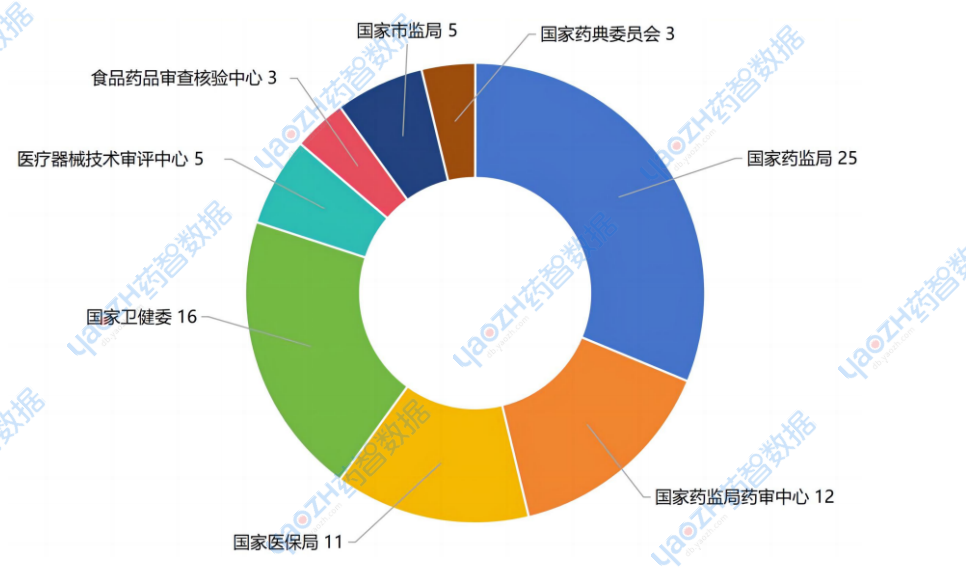
圖1 2025年1月國家部委發文數量
數據來源:藥智數據企業版-政策法規數據庫
本月醫藥政策速覽
藥品類
▲1月2日,國家藥監局關于發布《藥品生產質量管理規范(2010年修訂)》藥用輔料附錄、藥包材附錄的公告(2025年第1號)
該公告制定藥用輔料和藥包材附錄作為配套文件,對藥用輔料、藥包材生產企業、藥品上市許可持有人提出質量管理要求,并規定藥品監管部門的監督管理職責,自 2026 年 1 月 1 日起施行。
▲1月2日,國家藥典委員會關于發布《國家藥用輔料標準編寫細則(2025年版)》的通知
在《國家藥用輔料標準編寫細則(2020年版)》的基礎上修訂形成了《國家藥用輔料標準編寫細則(2025年版)》。
▲1月3日,國務院辦公廳關于全面深化藥品醫療器械監管改革促進醫藥產業高質量發展的意見
以習近平新時代中國特色社會主義思想為指導,提出到 2027 年和 2035 年的目標,部署加大研發創新支持、提高審評審批質效、提升產業合規水平、擴大對外開放合作、構建監管體系等 5 方面 24 條改革舉措,推動我國從制藥大國向制藥強國跨越,滿足群眾對高質量藥品醫療器械的需求。
▲1月7日,國家衛生健康委辦公廳關于印發新型抗腫瘤藥物臨床應用指導原則(2024年版)的通知
▲1月8日,國家醫保局發布關于對《國家基本醫療保險、工傷保險和生育保險藥品目錄(2024年)》部分藥品信息進行修正的公告
▲1月9日,國家藥監局藥審中心關于發布《化學仿制藥口服制劑經腸內營養管給藥體外對比研究技術指導原則》的通告(2025年第1號)
▲1月9日,國家藥監局藥審中心關于發布《治療子宮內膜癌新藥臨床研發技術指導原則(試行)》的通告(2025年第2號)
▲1月10日,國家藥監局藥審中心關于發布《抗猴痘病毒藥物臨床試驗技術指導原則(試行)》的通告(2025年第3號)
▲1月14日,國家藥監局藥審中心關于發布《化藥口服固體制劑中間產品存放時限研究技術指導原則》的通告(2025年第6號)
▲1月16日,國家藥監局藥審中心關于發布《放射性治療藥物申報上市臨床風險管理計劃技術指導原則》的通告(2025年第5號)
▲1月21日,國家藥監局關于簡化港澳已上市傳統口服中成藥內地上市注冊審批的公告(2025年第7號)
為貫徹落實國家建設粵港澳大灣區戰略部署,進一步支持香港特別行政區、澳門特別行政區(以下簡稱香港、澳門特區)中醫藥事業發展,更好融入國家發展大局,國家藥監局對港澳已上市傳統口服中成藥在內地上市注冊實施簡化審批。
▲1月23日,國家藥監局藥審中心關于發布《預防用mRNA疫苗非臨床研究技術指導原則》的通告(2025年第7號)
醫療器械類
▲1月6日,國家藥監局關于廢止YY/T 0771.1-2020 《動物源醫療器械 第1部分:風險管理應用》和YY/T 0771.2-2020 《動物源醫療器械 第2部分:來源、收集與處置的控制》醫療器械行業標準的公告(2024年第157號)
為進一步優化醫療器械標準體系,國家藥品監督管理局決定廢止YY/T 0771.1-2020 《動物源醫療器械 第1部分:風險管理應用》和YY/T 0771.2-2020 《動物源醫療器械 第2部分:來源、收集與處置的控制》2項醫療器械行業標準。
▲1月7日,國家藥監局發布《醫療器械監督管理條例(國務院令第276號)》
條例內容根據2024年12月6日《國務院關于修改和廢止部分行政法規的決定》第二次修訂。
▲1月15日,國家藥監局綜合司公開征求《醫療器械生產質量管理規范(修訂草案征求意見稿)》意見,1月16日,國家藥監局食品藥品審核查驗中心發布《醫療器械生產質量管理規范》修改前后對照表
國家藥監局于2025年1月15日在官網發布文件,向社會公開征求《醫療器械生產質量管理規范(修訂草案征求意見稿)》意見建議。為便于監管部門和企業理解修訂草案征求意見稿和2014年版《醫療器械生產質量管理規范》的主要變化,核查中心組織對新舊版本《醫療器械生產質量管理規范》進行了對比,現全文刊登如下,供廣大監管人員和業界從業人員研究參考。
其他
▲1月10日,國家衛生健康委辦公廳關于印發《國家衛生健康委主責國家重點研發計劃重點專項管理實施細則》的通知
為規范國家衛生健康委主責的國家重點研發計劃重點專項管理,保障專項組織實施,根據黨中央、國務院關于國家科技計劃管理改革的有關要求,以及科技部、財政部的相關暫行辦法,制定并實施該細則,以實現高效、科學、規范和公正的管理,確保重點專項順利實施并取得成效。
▲1月11日,國家醫療保障局關于開展2025年定點醫藥機構違法違規使用醫保基金自查自糾工作的通知
為持續推進醫保基金安全規范使用,國家醫保局決定在全國范圍內開展定點醫藥機構自查自糾工作。此次自查自糾工作涵蓋了定點醫療機構和定點零售藥店,重點檢查腫瘤、麻醉、重癥醫學等9個領域,要求各級醫保部門制定并細化問題清單,組織轄區內所有定點醫藥機構進行自查自糾,確保醫保基金的合理規范使用。
▲1月13日,國家藥監局食品藥品審核查驗中心關于發布《細胞治療產品生產檢查指南》的通告
▲1月14日,市場監管總局關于發布《特殊醫學用途全營養配方食品注冊指南》的公告
▲1月17日,國家藥監局食品藥品審核查驗中心關于發布《清潔驗證技術指南》的通告
▲1月22日,國家衛健委《關于印發流行性感冒診療方案(2025年版)的通知》
▲1月23日,國家藥監局藥審中心關于發布《疫苗說明書臨床相關信息撰寫指導原則(試行)》的通告(2025年第9號)
▲1月23日,國家醫療保障局發布《關于建立醫保數據工作組更好賦能醫療機構發展的通知》
國家醫保局決定建立醫保數據工作組,旨在通過數據賦能提升醫療、醫保、醫藥的協同發展和治理能力,加強醫保部門與定點醫療機構的 信息互通和改革協同,優化醫保基金管理,提高基金使用效率,促進醫療機構內部管理和服務行為的規范化,從而推動醫保醫療改革的深入發展。
▲1月24日,國家藥監局醫療器械技術審評中心發布關于第二次公開征求《體外診斷試劑變更注冊審查指導原則(征求意見稿)》意見的通知
▲1月27日,國家醫療保障局辦公室關于印發《按病種付費醫療保障經辦管理規程(2025版)》的通知
為貫徹落實《中共中央國務院關于深化醫療保障制度改革的意見》,根據《國家醫療保障局辦公室關于印發按病組和病種分值付費2.0版分組方案并深入推進相關工作的通知》要求,深化醫保支付方式改革,提高醫療保障基金使用效率,保障參保人員權益,做好按病種付費經辦管理工作,現制定本規程。
▲1月27日,國家醫療保障局發布《關于有序推進省內異地就醫住院費用納入按病種付費管理的通知》
為貫徹落實黨的二十大和二十屆二中、三中全會精神,深化醫保支付方式改革,規范異地就醫醫療服務行為,促進合理診療、因病施治,推動建立統一規范、內外協同、統籌平衡、安全高效的異地就醫醫保支付機制,決定在全國范圍內有序推進省內異地就醫住院費用納入按病種付費管理。
