文章來源:藥智網
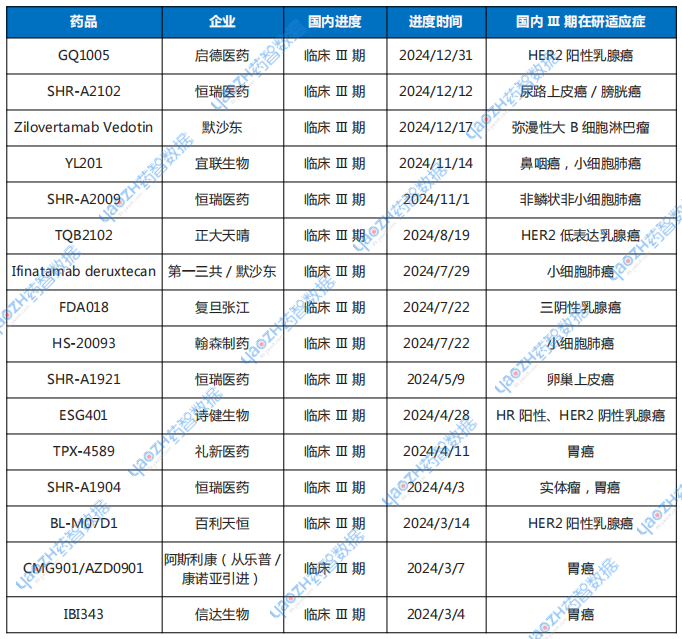
國產抗腫瘤ADC在數量上領跑,其中CLDN-18.2 ADC和B7-H3 ADC藥物競爭尤為激烈。信達生物、阿斯利康/樂普/康諾亞、恒瑞、禮新醫藥的四款CLDN-18.2 ADC,以及翰森制藥、第一三共/默沙東、宜聯生物的三款B7-H3 ADC均進入Ⅲ期臨床,有望獲批。進口ADC方面,默沙東的ROR1 ADC也進入Ⅲ期。
表1 2024年進入III期臨床的ADC藥物
1. 競爭激烈
CLDN-18.2作為一個在腫瘤發生和發展中具有重要作用的靶點,吸引了眾多藥企的關注。
信達生物的IBI343早在2024年年初就啟動了治療胃或胃食管交界處腺癌患者的三期臨床G-HOPE-001研究。它基于信達生物與Synaffix的合作采取差異化設計,進行了Fc Silence突變,避免ADCC介導的消化道毒性,還采取定點偶聯技術保證穩定均一的DAR4,同時使用了TOPO1i毒素,具有更強的旁觀者效應。雖然目前尚未披露人體實驗數據,只公開宣布胃癌達成概念驗證,但從一些初步信息能看出其潛力,比如劑量爬坡設置了5個檔,最高到10mg/kg;安全性上,胃腸道不良事件、低白蛋白血癥的發生率較低,因不良事件停藥的發生率也低;療效方面,初步驗證顯示治療的GC患者錄得了較高的ORR,大量患者獲得了高DCR。
康諾亞與樂普生物旗下美雅珂聯合研發的CMG901是全球首個Claudin 18.2 ADC藥物。在小鼠胃癌PDX模型研究中,CMG901表現出遠遠優于Claudin 18.2抗體的抗腫瘤活性。其Ⅰ期臨床研究最新數據顯示,89例可評估的CLDN18.2陽性G/GEJ腺癌患者在三個劑量組的確認的客觀緩解率(ORR)為35%,確認的疾病控制率(DCR)為70%。其中,2.2mg/kg劑量組確認的ORR為48%,中位無進展生存期(mPFS)為4.8個月,中位總生存期(mOS)為11.8個月。
恒瑞的SHR-A1904啟動了兩項Ⅲ期研究,一項是Ib/Ⅲ期臨床研究,其中Ⅲ期部分旨在評估SHR-A1904聯合化療和免疫一線治療CLDN18.2陽性晚期實體瘤是否優于化療聯合免疫;另一項Ⅲ期研究針對的適應癥為晚期胃癌或胃食管結合部腺癌,全方位布局,力求在不同治療策略和患者群體中探索藥物的最佳療效。
禮新醫藥的TPX-4589同樣在這場競爭中不遑多讓,雖然目前公開信息相對較少,但能進入Ⅲ期臨床,也足以證明其在研發過程中攻克了諸多難題,具備自身獨特的優勢,有望在后續研究中給我們帶來驚喜。
CLDN-18.2 ADC的競爭不僅是藥企之間研發實力的較量,也是對如何更好地滿足患者需求、克服技術難題的考驗。誰能夠率先在Ⅲ期臨床中取得優異的結果,實現藥物的成功獲批,將在腫瘤治療領域贏得重要的一席之地。
2. 誰摘得桂冠?
B7-H3也是一個備受關注的腫瘤相關靶點,翰森制藥、第一三共/默沙東、宜聯生物的三款B7-H3 ADC進入Ⅲ期臨床,競爭摘取桂冠的局勢同樣引人關注。
宜聯生物的YL201是基于TMALIN?開發的B7-H3 ADC。2024年ESMO大會披露的Ⅰ期臨床數據顯示其抗腫瘤活性良好,廣泛期小細胞肺癌隊列例可評估患者,既往都接受過含鉑化療,95%接受過抗PD-(L)1治療,YL201的ORR為68.1%,mPFS為6.2個月;腦轉移患者(n=26)中,ORR為52.2%,mPFS為5.3個月。鼻咽癌隊列7例可評估患者,此前接受過抗PD-(L)1和鉑類化療,約75%接受過≥2線標準療法,YL201的ORR為48.6%,mDoR為11.1個月、DCR為92.9%、mPFS為7.2個月。YL201去年10月被CDE納入復發性小細胞肺癌突破性治療,11月獲美國FDA授予孤兒藥資格用于治療食管癌。
第一三共/默沙東的Ifinatamab deruxtecan是基于DXd ADC技術平臺開發的B7-H3 ADC。2023年9月公布的I/II期研究結果顯示,21例晚期SCLC患者經過治療后,確認的ORR為52.4%,其中包括1例完全緩解(CR)和10例為部分緩解(PR);中位緩解持續時間(mDOR)為5.9個月。安全性方面,36.4%的患者發生3級或更高級別的治療期間不良事件(TEAE)。目前正開展針對先前治療過的廣泛期SCLC患者的II期臨床試驗,且默沙東與第一三共計劃啟動MK-6070聯合ifinatamab deruxtecan用于SCLC的臨床研究,進一步探索聯合治療的潛力。
翰森制藥HS-20093是一種新型B7-H3靶向ADC,由全人源化的B7-H3單抗與拓撲異構酶抑制劑(TOPOi)有效載荷共價連接而成。2024年8月獲FDA突破性療法認定,用于含鉑化療期間或之后進展的(復發或難治性)廣泛期小細胞肺癌(ES-SCLC)患者治療,該認定得到了翰森制藥正在推進的ARTEMIS-001Ⅰ期開放標簽、多中心試驗的數據支持。同年11月,HS-20093又獲得中國國家藥品監督管理局批準,納入突破性治療藥物,適應癥為經過標準一線治療后進展的廣泛期小細胞肺癌(ES-SCLC),目前在中國進行針對小細胞肺癌的II期臨床研究,同時還涉及多項I期和II期研究,適用于肉瘤、頭頸癌等其他實體瘤。
這三款藥物在B7-H3 ADC賽道各有優勢,研發進展都十分可觀,最終誰能率先獲批,值得持續關注。
3. 恒瑞底蘊深厚
恒瑞醫藥作為國內知名的藥企,在ADC藥物的研發方面展現出了深厚的底蘊,有四款ADC挺進Ⅲ期臨床,數量居行業前列,彰顯了其在腫瘤藥物研發領域的實力。
恒瑞的ADC藥物研發涉及多個靶點,其中,SHR-A2102(針對Nectin-4)成為繼邁威生物9MW2821后,第二款進入Ⅲ期臨床的國產Nectin-4 ADC,專注于局部晚期或轉移性尿路上皮癌治療。SHR-A2009(針對HER3)則開創了國產HER3 ADC進入Ⅲ期臨床的先河,針對EGFR突變晚期或轉移性非小細胞肺癌。此外,SHR-A1921(針對TROP2)在鉑耐藥復發上皮性卵巢癌治療領域獨樹一幟,是首個且目前唯一進入Ⅲ期臨床的TROP2 ADC。而SHR-A1904(針對CLDN-18.2)更是同時開展了兩項Ⅲ期研究,一項評估其聯合化療和免疫治療CLDN18.2陽性晚期實體瘤的效果,另一項則專注于晚期胃癌或胃食管結合部腺癌的治療。
總結而言,恒瑞醫藥憑借其深厚的研發底蘊、多元化的靶點布局、完善的研發體系和強大的市場資源,在2025年有望獲批的ADC藥物競爭中占據重要地位。如果其ADC藥物能夠成功獲批上市,將進一步提升恒瑞在腫瘤藥物領域的競爭力,為患者帶來更多創新的治療選擇。
4. 結語
ADC藥物作為腫瘤治療領域的“明日之星”,正以迅猛之勢改寫著癌癥治療的格局。2025年有望獲批的這些ADC藥物,無論是在靶點選擇的創新性上,還是臨床研究數據展現出的有效性、安全性上,都讓人眼前一亮。
