文章來源:藥智新聞
全球新藥2025年1月進展概述
1.1 進展到最新階段的重點項目
1月共676個藥物有相關更新動態,其中有309個項目推進到最新的階段,其中在中國境內進行的項目共216個,境外項目有93個。
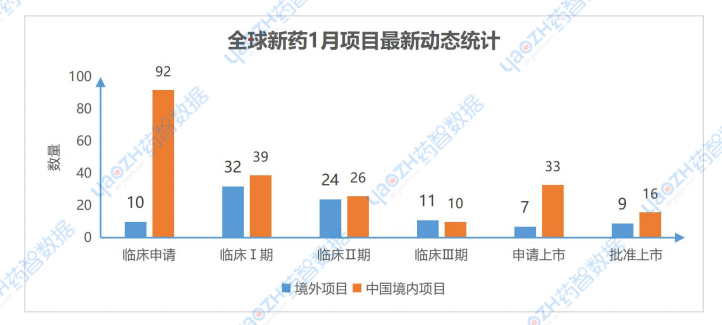
數據來源:藥智數據企業版-全球藥物分析系統
1.2 研發前十靶點
1月有更新動態的676個項目中,涉及最多的靶點是GLP-1R,其次是PD-1和PD-L1,以下是排名前十的靶點,圖中僅展示藥品總數,具體藥品內容可通過全球藥物分析系統進行查看。
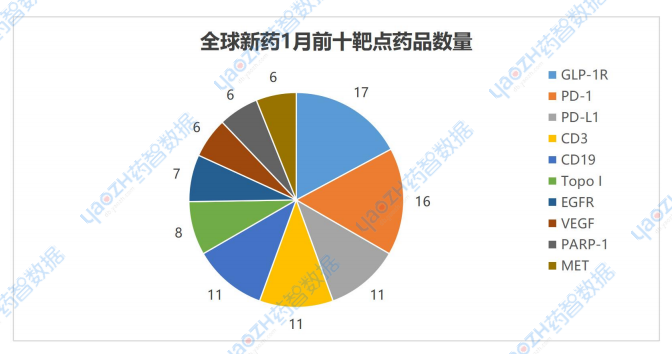
數據來源:藥智數據企業版-全球藥物分析系統
1.3 研發前十適應癥
1月有更新動態的676個項目中,涉及最多的適應癥是實體瘤,其次是晚期實體瘤和非小細胞肺癌,以下是排名前十的適應癥及其全球最高研發階段情況,圖中僅展示藥品總數,具體藥品內容可通過全球藥物分析系統進行查看。
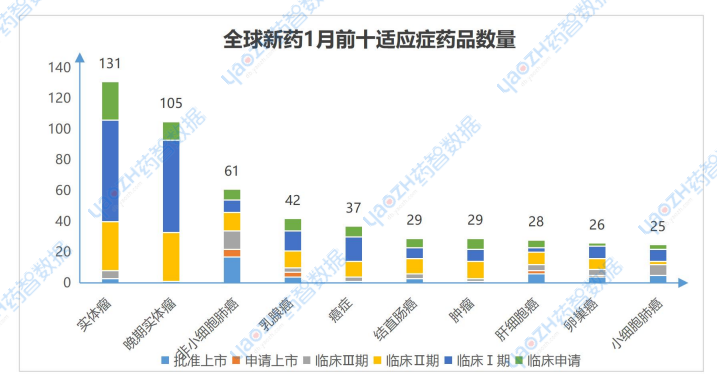
數據來源:藥智數據企業版-全球藥物分析系統
1.4 研發前十藥品類別
從成分類別分析,1月有最新進展的相關藥品占比前三的分別是化藥59%,抗體17%,細胞5%。
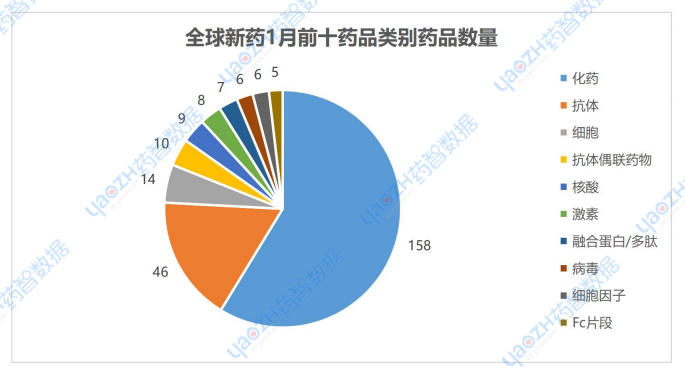
數據來源:藥智數據企業版-全球藥物分析系統
全球新藥2025年1月重點項目
2.1 全球獲批的新藥
據全球藥物分析系統數據庫統計,1月全球共25款藥物獲批上市(包括新獲批適應癥),其中境外9個上市藥品,中國境內16個藥品,下表展示部分重點上市藥物。
更多內容前往藥智數據公眾號后臺回復【全球新藥】,獲取完整《2025年各月全球新藥研發進展》PDF版及申請/獲批上市藥物清單excel版。
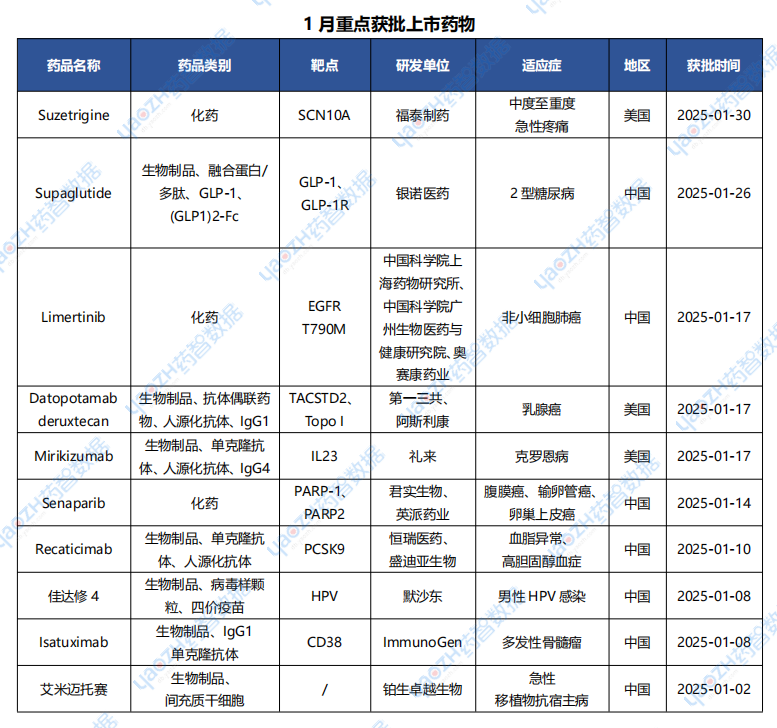
數據來源:藥智數據企業版-全球藥物分析系統
2.1.1 Suzetrigine——全球首個非阿片類止痛藥FDA批準上市
2025年1月30日,FDA宣布已批準Vertex公司的創新療法Suzetrigine(Journavx,VX-548)上市,用于治療成人中度至重度急性疼痛。Suzetrigine是一種新型非阿片類鎮痛藥,是全球首款獲批上市的治療疼痛的NaV1.8抑制劑,是美國FDA所批準的首款基于新機制的非阿片類止痛藥物,該藥物的獲批將使之成為20多年來首個用于治療急性疼痛的新機制藥物。
FDA長期以來一直支持非阿片類止痛藥的研發,并發布了旨在鼓勵研發非阿片類止痛藥治療急性疼痛的指導草案和臨床實踐指南。據全球藥物分析系統數據庫統計,目前全球共有26款靶向NaV1.8新藥正在研發當中,分別用于各種疼痛包括急性疼痛、慢性疼痛、術后疼痛、關節疼痛等。國內市場包括恒瑞、濟煜醫藥、海博為藥業、健康元藥業也有相關靶向NaV1.8藥品進入臨床早期階段。
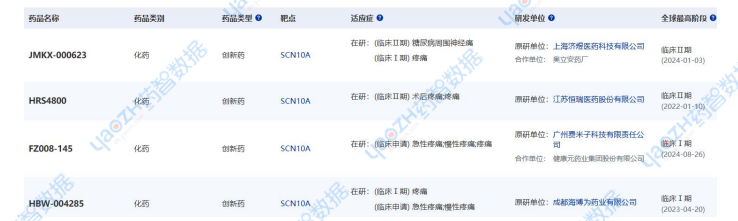
▲國內靶向NaV1.8疼痛市場研發格局
圖片來源:藥智數據企業版-全球藥物分析系統
2.1.2 Recaticimab——全球首個超長效PCSK9單抗國內獲批上市
2025年1月10日,中國國家藥監局批準恒瑞醫藥的注射用瑞卡西單抗(Recaticimab)上市,瑞卡西單抗是恒瑞在心血管疾病領域上市的首個1類創新藥,其注射間隔可長達8周,突破了目前國內外已獲批的PCSK9單抗需要每2周、4周或6周的注射頻次,是全球首個超長效PCSK9單抗。
此次獲批上市的適應癥為:在控制飲食的基礎上,與他汀類藥物,或者與他汀類藥物及其他降脂療法聯合用藥,用于接受中等或以上劑量他汀類藥物治療仍無法達到低密度脂蛋白膽固醇(LDL-C)目標的原發性高膽固醇血癥(包括雜合子型家族性和非家族性高膽固醇血癥)和混合型血脂異常的成人患者;或單藥用于非家族性高膽固醇血癥和混合型血脂異常的成人患者,以降低低密度脂蛋白膽固醇(LDL-C)、總膽固醇(TC)、載脂蛋白B(ApoB)水平。
2.1.3 艾米邁托賽——國內首款干細胞療法批準上市
2025年01月02日,中國國家藥監局批準鉑生卓越生物的干細胞療法艾米邁托賽獲批上市,用于治療14 歲以上消化道受累為主的激素治療失敗的急性移植物抗宿主病。這是國內首款獲批上市的干細胞療法,填補了國內干細胞治療的空白。在這款干細胞產品獲批前不久,2024年12月18日,美國FDA也批準了第一個基于間充質干細胞的治療療法Ryoncil(remestemcel-l)用于治療類固醇難治性急性移植物抗宿主病。短短半個月時間,中美兩國兩款干細胞產品相繼獲批,這不僅是干細胞行業劃時代的突破,也是干細胞治療從技術時代邁向產品時代的關鍵里程碑。
在所有干細胞療法中,間充質干細胞療法是最為熱門的類別。據全球藥物分析系統數據庫統計,目前全球共有235個間充質干細胞項目在研發階段,處于斷層式領先,而緊隨其后的是造血干細胞僅有74個項目,其他還包括脂肪干細胞、神經干細胞、胚胎干細胞等多種干細胞療法均在開展臨床探索研究。
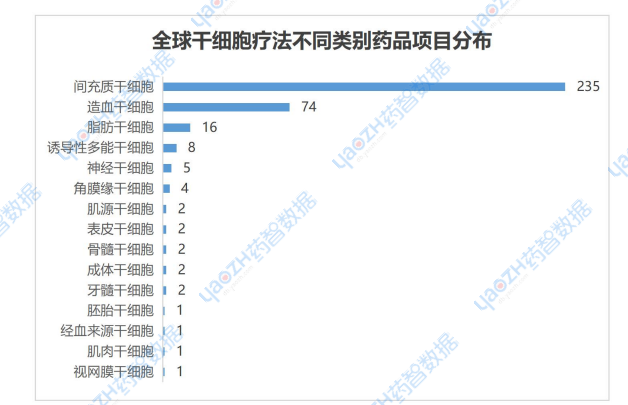
▲全球干細胞療法不同類別藥品項目分布
圖片來源:藥智數據企業版-全球藥物分析系統
2.2 全球申請上市的新藥
據全球藥物分析系統數據庫統計,1月全球共40款藥物申請上市(包括首次申請和新申請),下表展示部分重點申請上市藥物。
更多內容前往藥智數據公眾號后臺回復【全球新藥】,獲取完整《2025年各月全球新藥研發進展》PDF版及申請/獲批上市藥物清單excel版。
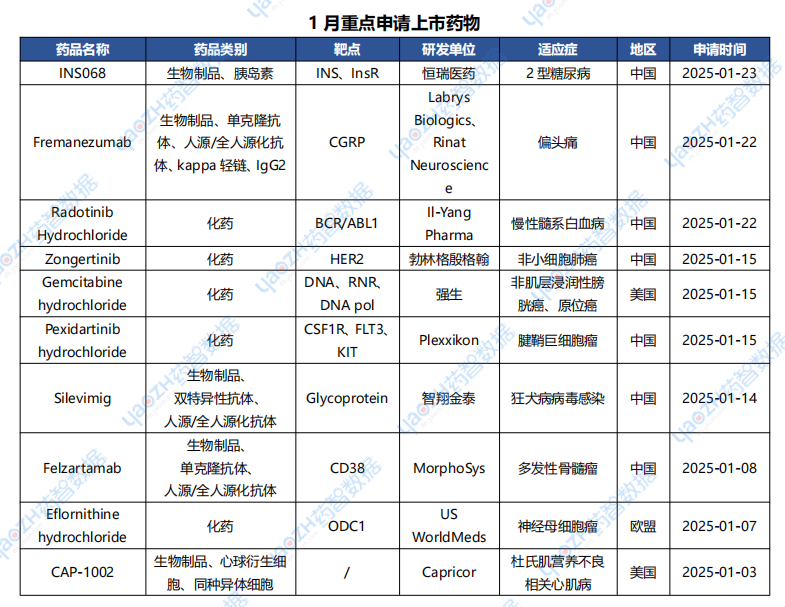
數據來源:藥智數據企業版-全球藥物分析系統
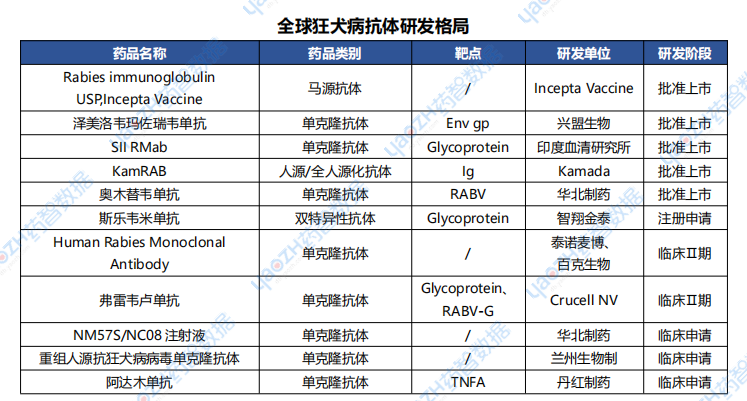
2.2.1 Silevimig——全球首款狂犬病雙抗藥物國內申請上市
2025年1月14日,據CDE 官網顯示,智翔金泰1類新藥斯樂韋米單抗(Silevimig,GR1801)在國內報上市,用于疑似狂犬病病毒III級暴露后的被動免疫。如果成功獲批,該藥將成為狂犬病領域全球首款且目前唯一的雙抗藥物。
據全球藥物分析系統統計,在狂犬病抗體研發領域共11款藥物進入臨床開發及以上階段,其中有8款單抗、1款雙抗、2款其他抗體。目前國內已知獲批上市的僅2款抗狂犬病毒單抗,分別為華北制藥的奧木替韋單抗和興盟生物開發的重組人源化單抗澤美洛韋瑪佐瑞韋單抗。
數據來源:藥智數據企業版-全球藥物分析系統
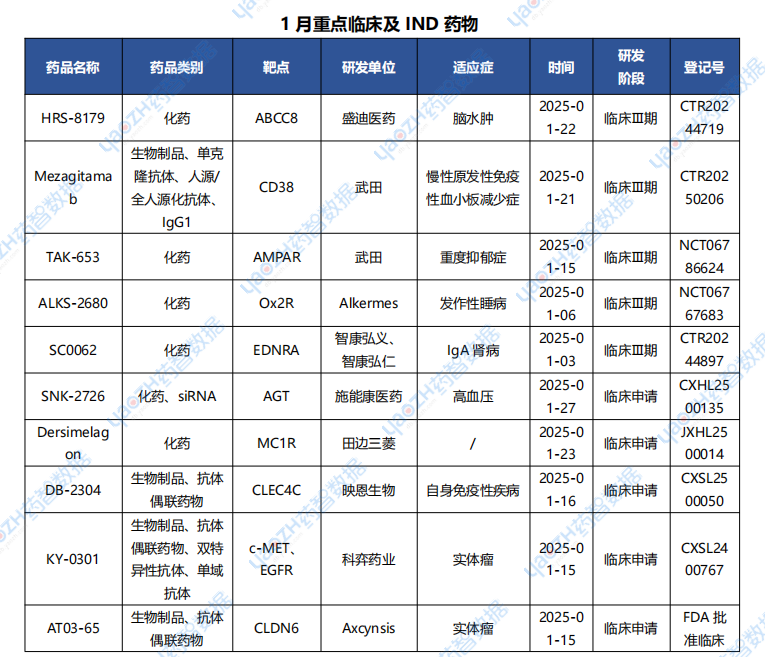
2.3 全球新藥重點臨床試驗及IND申請
據全球藥物分析系統數據庫統計,2025年1月“首次”進入重點臨床試驗(三期)的新藥項目有21個,臨床申請有102個,下表展示部分重點信息。
更多內容前往藥智數據公眾號后臺回復【全球新藥】,獲取完整《2025年各月全球新藥研發進展》PDF版及申請/獲批上市藥物清單excel版。
數據來源:藥智數據企業版-全球藥物分析系統
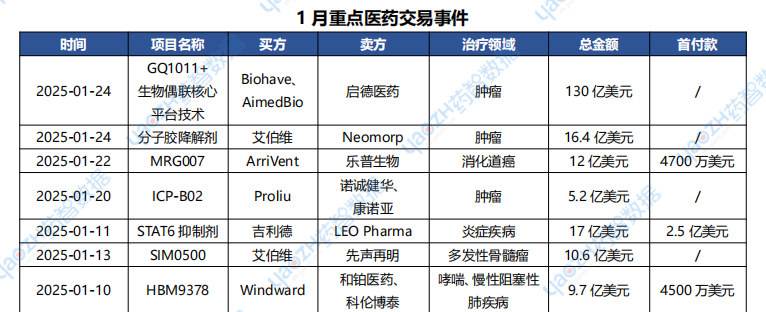
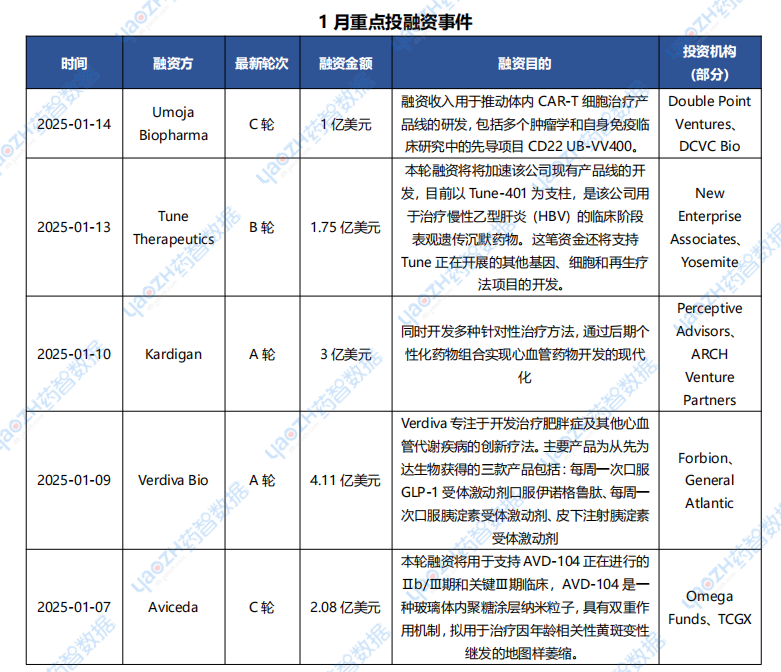
1月醫藥交易、投融資及并購事件
據投資格局數據庫統計,2025年1月共247條醫藥交易事件、167條醫藥投融資事件和43項企業并購事件發生,重點交易信息如下,完整清單詳見藥智數據企業版-投資格局數據庫。
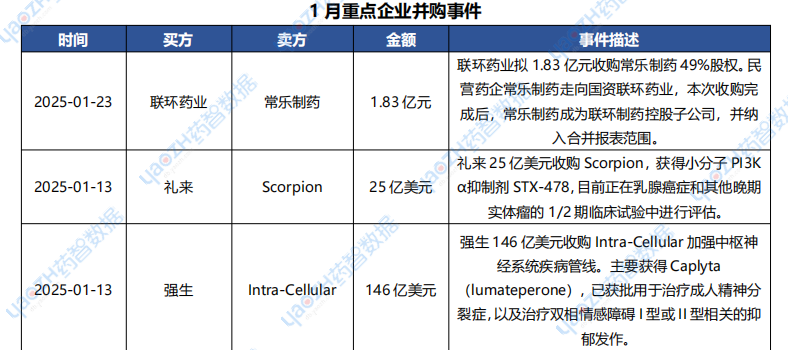
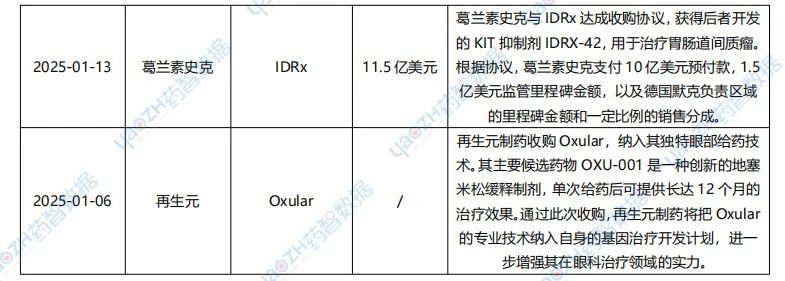
數據來源:藥智數據企業版-投資格局數據庫
2025年各月全球新藥研發進展完整報告
